Six-legged walking in insects: how CPGs, peripheral feedback, and descending signals generate coordinated and adaptive motor rhythms
郑重声明:原文参见标题,如有侵权,请联系作者,将会撤销发布

JOURNAL OF NEUROPHYSIOLOGY, no. 2 (2018): 459-475
Bidaye SS, Bockemühl T, Büschges A. 昆虫中的六足行走:CPG、外围反馈和下降信号如何产生协调和适应性的运动规律。J Neurophysiol 119:459–475,2018。首次出版:2017年10月25日,doi:10.1152/jn.00658.2017.——步行是有腿动物的一种有规律的运动行为,其潜在机制一直是神经生物学研究的主题超过100年。在本文中,我们回顾了该研究领域的相关历史方面和当代研究,特别关注中央模式生成网络(CPG)的作用及其对昆虫六足行走生成的贡献。重要的方面是单腿踏步的产生、腿间协调的产生以及下降信号如何影响步行。我们首先回顾了CPG如何与来自腿部的感觉信号在腿部踩踏的产生过程中相互作用。接下来,我们总结了这些相互作用如何在向前和向后行走、曲线行走和速度变化的运动灵活性的产生中进行修改。然后,我们回顾了关于CPG在节间协调中的作用以及CPG如何参与调节大脑下行影响以启动、维持、修改和停止行走运动输出的知识现状。在整个过程中,我们的目标是专门解决知识差距,我们描述了潜在的未来途径和方法,包括概念和方法论,后者强调由于神经遗传学方法在该研究领域的出现及其与传统方法的结合而产生的特定选择。
INTRODUCTION
运动性通常被认为是动物的定义特征之一。大多数动物在其生命周期的某个时间段内是能动的。有些运动是对特定刺激的急性反应,而其他较长时间尺度的运动行为(也称为"运动规律")由重复的运动模式组成,包括对动物生存至关重要的基本行为,例如进食、呼吸、运动和求爱。这些运动规律是由效应肌肉的规律性收缩引起的,产生这些规律的部位位于动物的神经系统中。几十年来,神经系统如何产生这种规律一直是神经科学研究的热门话题。一些运动规律,例如呼吸或心跳,由相对较少的肌肉组成,在动物的整个生命周期中以相当规律的间隔收缩,产生这种规律的潜在神经机制也相对容易概念化。另一方面,诸如步行之类的运动规律需要大量肌肉的协调收缩,并且更具动态性。尽管如此,上述所有运动行为的有规律的运动活动已被集体证明是由中枢神经系统(CNS)中的专门网络的贡献产生的,该网络可以在外部输入的连续激活时本质上产生有规律的运动输出,或者来自大脑或神经系统的其他区域,即所谓的"中枢模式发生器"(CPG)(评论参见 Katz and Hooper, 2007; Marder and Rehm, 2005; Orlovsky et al., 1999; Smith et al., 2013)。
与上面提到的大多数其他有规律的运动模式相比,动物在可变基板上行走的步进模式需要根据地面的不平整度以及其他环境和内部刺激不断更新。这需要整合复杂的和状态相关的感官信息和CPG派生的输出,以产生适当的行走运动输出。因此,产生协调和适应性规律的潜在神经回路的机械细节尚不清楚,是积极研究的目标。具体而言,了解产生协调行走的神经回路一直是包括人类在内的多种动物物种的研究重点(Hooper and Büschges, 2017),部分原因如下。首先,步行是大多数陆生动物行为的重要组成部分。此外,这些研究为研究复杂的神经回路功能提供了机会,其中回路的输出很容易量化(例如,Orlovsky et al., 1999)。最后,步行是可靠的地面运动的最佳模式之一,从研究中得出的原理可以外推到机器人技术和其他工程应用中(例如,Buschmann et al., 2015; Hooper and Büschges, 2017)。
关于神经元的数量,一般无脊椎动物,特别是昆虫,具有相对简单的神经系统,但表现出复杂的步行行为。这使它们成为找出产生如此复杂规律行为的神经回路原理的理想模型。事实上,跨越几十年的研究已经在这个领域产生了大量的文献。结合神经生理学和神经遗传学技术的最新进展,现在似乎是解开该领域关键概念见解的好时机,特别是关于CNS中的CPG在产生协调和适应性的运动输出中发挥什么作用的问题。在本文中,我们旨在回顾该领域的当前知识,特别关注昆虫在不同昆虫物种间行走的CPG功能的实验证据。尽管在本期特刊中,我们将概述集中在步行背景下的CPG,但重要的是要注意,仅CPG不足以产生和解释昆虫的步行行为。因此,我们将专门报告阐明CPG如何与感觉信息和下行大脑输入相互作用以协调行走昆虫的六条腿的协调运动的观察结果。我们希望综合该领域作为一个整体的位置的总体概念概述,并为有希望的未来调查提出观点,旨在解决我们目前理解中的差距。
EVIDENCE FOR CPGS AS PART OF THE LEG MUSCLE CONTROL SYSTEM FOR WALKING IN INSECTS
从1960年代开始,对有规律的活动神经网络在动物中枢神经系统中的作用和组织的研究,在产生用于运动的有规律的运动输出的基础上经历了真正的推动(例如,Clarac and Pearlstein, 2007)。从那时起,在各种系统中都发现了本质上能够产生有规律的运动输出的中枢神经网络。1960年,Hughes和Wiersma表明,完全分离的甲壳类动物腹部神经索能够产生有规律的运动输出,用于搏动腹部游泳动物,使用小腿状附属物用于游泳(Hughes and Wiersma, 1960)。一年后,Wilson (1961)发表了一项极具影响力的研究,其中他表明,当连续的风流持续流动指向动物的头部时,仅附着在头部的蝗虫胸神经索完全传入神经阻滞,会在翼升肌和降翅肌中产生交替活动。这种网络被称为中央模式发生器(CPG),因为它们能够在没有相位或有规律的输入的情况下产生有规律的运动输出。在接下来的几年里,各种动物规律性运动输出的起源可以追溯到CPG的活动,例如甲壳类动物的咀嚼运动(Maynard, 1966)、蜻蜓的呼吸(Mill and Hughes, 1966)、甲壳类动物的心脏活动(Hagiwara and Bullock, 1957)、水蛭的运动规律性(Kristan and Calabrese, 1976)、软体动物的游泳(Arshavsky et al., 1985)和蜗牛的取食(Kater and Rowell, 1973)。连同对脊椎动物运动系统的研究(评论参见,例如,Clarac, 2008; Orlovsky et al., 1999),上述研究扩展了对神经系统如何集中产生有规律的运动输出的见解。他们建立在20世纪初George Brown (1911, 1914)的工作之上,他在他的经典实验中展示了猫脊髓里中枢规律机制的存在。
有趣的是,将昆虫行走作为一种有规律的行为形式的早期研究强调了感觉信号和反射的重要性以及它们在这种情况下建立适当运动输出的假定充分性(即,Wendler, 1964; Wilson, 1965)。直到一段时间后,Pearson (1972)的一项研究才提供了CPG对步行的作用的第一个证据。这项研究显示了中枢神经网络活动的证据,该活动是在拮抗的臀部肌肉和支配它们的运动神经元池之间产生交替活动的基础。随后对昆虫的研究证实了交替运动活动产生背后的中枢神经网络的存在。Bässler和Wegner (1983)表明,通过触觉刺激动物的头部或腹部,可以在传入神经阻滞的胸神经系统中诱导拮抗腿运动神经元池的交替活动(另见Büschges et al., 2004)。Ryckebusch和Laurent (1991)在蝗虫中的发现,继之前在甲壳类动物(Chrachri and Clarac, 1987)中的发现之后,令人信服的证据表明,CPG存在驱动腿部运动神经元的交替规律性活动,以便在节段性胸神经节中运动。在蝗虫孤立的胸神经索中毒蕈碱胆碱能受体的药理学激活后,作者报告了在驱动单腿关节的拮抗腿运动神经元中诱导持久的交替规律活动。从那以后,竹节虫(Büschges et al., 1995)、天蛾(Johnston and Levine, 2002)和蟑螂(Fuchs et al., 2011)也有类似的发现。
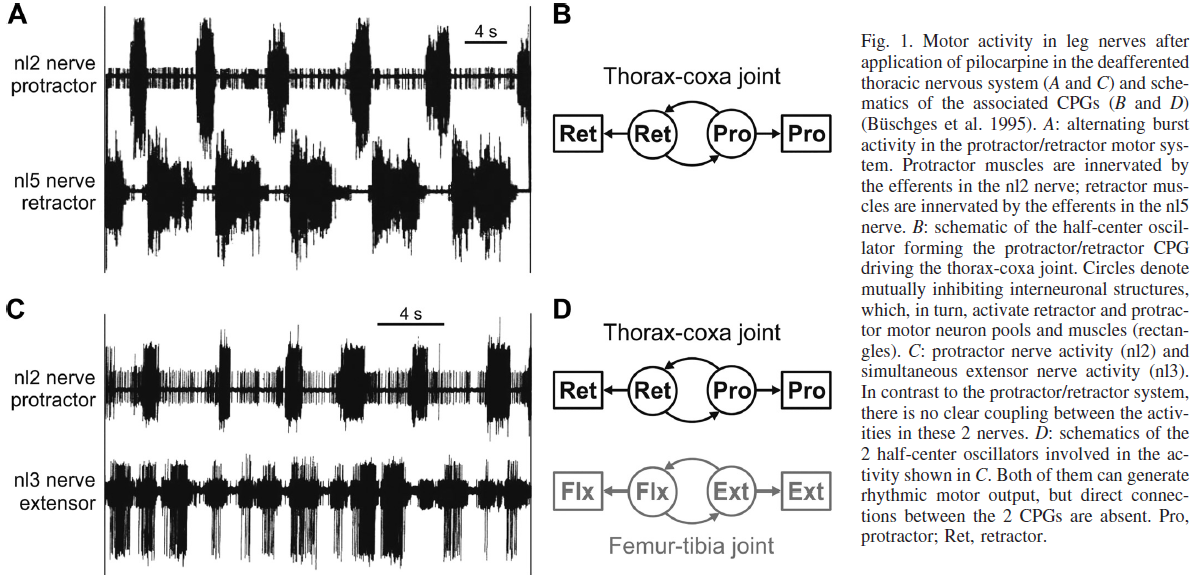
在蝗虫和竹节虫中,也有关于驱动昆虫腿的三个主要腿关节的运动神经元池活动的相位关系的数据,即胸部-髋关节(产生水平伸展和收缩运动),髋-转子关节(产生垂直的抬高和下沉),以及股骨-胫骨关节(产生胫骨的伸展和屈曲)。在这两个物种中,毒蕈碱兴奋剂毛果芸香碱在拮抗性腿部运动神经元池中诱导持久的交替规律活动(图1A)。有趣的是,在蝗虫(Ryckebusch and Laurent, 1991)与竹节虫(Büschges et al., 1995)相比,作者报告了负责三个主要腿关节的运动神经元池之间的一些协调:在站立运动期间通常同时处于活动状态的运动神经元池在这种传入神经阻滞的制剂中表现出对同相活动的偏好。由于这种相似性,作者得出结论,蝗虫胸神经节能够产生"虚构的步进运动模式",尽管具有更高的可变性。相比之下,来自类似竹节虫制剂的数据并未显示连续运动活动周期的首选相位耦合(图1, C和D)。相反,观察到三个腿关节的拮抗运动神经元池中规律活动的普遍独立性。仅报道了这些运动神经元池之间罕见且短暂的协调。总之,竹节虫数据表明至少存在三个单独的CPG控制三个主要的腿关节,即胸-髋关节、髋-转子关节和股骨关节(Büschges et al., 1995)。值得一提的是,在蝗虫中,只评估了那些表现出明显协调活动的记录时期(Ryckebusch and Laurent, 1991),而在竹节虫中,评估了所有记录(Büschges et al., 1995)。进一步的证据支持CPG在昆虫行走中的贡献:Borgmann et al. (2009)表明,前腿跨步可以激活和带动听神经后段的交替且有规律的运动活动。反过来,然后可以通过刺激局部感觉反馈途径来修改和夹带这种活动(Borgmann et al., 2009, 2011)。总之,竹节虫的结果为竹节虫胸神经节中存在多个CPG提供了证据。这些中的每一个都能够在由它们支配的拮抗运动神经元池中产生交替活动。这些发现构成了对由Grillner和Zangger (1979)假设制定的单位突发发生器(UBG)概念的首次验证,用于组织控制猫后肢的神经元网络。这一概念是基于猫脊髓产生的各种后肢运动模式不能仅由一个CPG网络产生的概念而制定的。最近,还发现这种CPG网络组织存在于控制后肢运动的小鼠腰脊髓中(Büschges and Borgmann, 2013; Häglund et al., 2013)。
根据这些结果,很明显CPG在产生用于昆虫踏步的运动输出方面发挥着重要作用。这就产生了如何构建这些CPG的问题。目前,对于在任何昆虫中促成这种运动输出的CPG的拓扑结构,还没有确凿的鉴定。一个持久的障碍是获得对昆虫神经索中枢神经元的有针对性且可重复的电生理通路的挑战。表征构成CPG的中间神经元的进一步复杂化是区分处理或中继外部信号的神经元,例如,在步进过程中自然发生的节间或相位感觉信号,与实际上是产生有规律运动输出的CPG网络的一部分的神经元。
尽管如此,考虑到这些注意事项,存在形态学和电生理学特征的中间神经元,其中一些跨不同的昆虫物种,它们与步行环境中规律性运动输出的产生有关。Pearson和Fourtner (1975)首先在蟑螂中发现了后胸神经节中的一个局部非脉冲中间神经元(中间神经元 I),他们提出将其作为候选CPG神经元。该中间神经元显示出与腿部运动同步的膜电位振荡。此外,在这个中间神经元中注入小的去极化或超极化电流会导致几个运动神经元池的发放率发生变化,特别是提肌运动神经元。最重要的是,在运动神经元放电周期的特定阶段向中间神经元注入小的去极化电流可以重置规律。这表明该中间神经元是模式生成网络的重要组成部分。类似地,在竹节虫中,三个局部运动前非脉冲中间神经元被鉴定为CPG的元素,这些CPG控制驱动中胸腿中的髋-转子和股骨-胫骨关节的运动神经元的活动,即两个E4型中间神经元(Bässler and Büschges, 1998; Büschges, 1990; Büschges et al., 1994, 1995; Büschges and Wolf, 1995; Sauer et al., 1996)和一个I4型中间神经元(Büschges, 1995; Büschges and Wolf, 1995; Sauer et al., 1996)。在药理学激活的孤立中胸神经节以及半完整的腿踏步期间,电流注入中间神经元E4导致正在进行的运动神经元活动甚至踏步的重置(Bässler and Büschges, 1998; Büschges et al., 1994; Büschges and Wolf, 1995)。目前,仅知道中间神经元I4在分离的中胸神经节的药理学活化剂中发挥这种作用(Büschges, 1995)。有趣的是,在竹节虫中鉴定的这些中间神经元与Pearson和Fourtner (1975)描述的中间神经元 I 显示出形态相似性。仍然需要进一步研究破解昆虫胸神经节中节段CPG网络的拓扑结构,以解开CPG的组织和操作,这些CPG有助于在行走期间产生协调的运动活动。
如上所述,有明确的证据表明CPG对于在昆虫中行走很重要。然而,正如我们将在本次回顾中反复展示的那样,仅靠CPG不足以建立在昆虫中行走所需的适当运动输出。相反,它们的基本规律强烈地受到感官信息的塑造和影响。只有结合这两个元素才能产生类似体内的步行行为。
COORDINATING MULTIPLE JOINTS FOR SINGLE-LEG STEPPING
根据物种的不同,昆虫腿至少由五个可以单独移动的部分组成。它们是髋部、转子、股骨、胫骨和至少四个跗骨节段。这些节段由十多块肌肉驱动(Bässler, 1983; Burrows, 1996; Goldammer et al., 2012)。胸-髋、髋-转子和股-胫之间的主要腿关节由成对的拮抗肌控制;例如,髋部由量角器和牵开器的髋部肌肉控制(图1A)。跗骨节段受到统一控制,特别是由单一的三方肌肉(指甲牵开器)控制。该肌肉介导跗骨节段的弯曲。为了产生腿部运动,例如步行的步数,必须产生肌肉激活的特定时间序列(例如,Duch and Pflüger, 1995; Fischer et al., 2001; Graham, 1985; Graham and Epstein, 1985; Graham and Wendler, 1981; Rosenbaum et al., 2010)。
目前,关于负责生成协调运动输出的神经机制的最全面知识存在于竹节虫的中腿(Büschges et al., 2008)。竹节虫的中腿非常适合步行研究,因为与前腿和后腿相比,它们在功能上最不专业(Dallmann et al., 2016)。前腿除了经常在触觉上用于在通常不可预测的环境中寻找支撑之外(Cruse, 1976; Grabowska et al., 2012; Graham, 1985),还位于前胸段。在尾感器中, 前胸段的小尺寸和特定的内部结构使其难以访问,特别是在半完整制剂的电生理记录方面。另一方面,后腿专门用于应对动物的重心位于两条后腿臀部之间的身体挑战。
在中腿中,已经研究了来自腿部感觉器官的信号在产生用于步进运动的运动输出中的作用。特别关注的问题是这些信号中哪些通过反射样通路改变运动输出,哪些直接作用于CPG。最详细地研究的信号源自两类感觉结构:股骨脊索器官(fCO)(例如,Bässler, 1983; Hess and Büschges, 1999)、运动传感器和钟状感受器(CS)(例如,Akay et al. 2001, 2004, 2007; Borgmann et al., 2011),负责检测力和载荷。已经发现这些感觉器官的相位和强直信号对驱动三个主要腿关节的CPG活动的特定影响对在步进期间产生适当的运动活动时间序列有很大贡献(图2)。例如,在向前行走期间,来自大转子和股骨上的CS的负荷信号启动和维持牵开器并终止量角器髋部活动(Akay et al., 2007)。此外,它们启动和维持抑制肌活动并终止提肌粗隆肌活动(Borgmann et al., 2011),最后,启动屈肌胫骨活动(Akay et al., 2001)。在这样做时,它们有助于启动和维持站立运动所需的电机输出。相比之下,调节腿部卸载的CS信号支持向摆动运动的过渡。来自fCO的屈曲信号启动提肌转子活动并终止下压转子活动,而伸展信号引起相反的效果(Hess and Büschges, 1999)。这分别有助于站姿和摆动运动之间的过渡,反之亦然。其他昆虫也显示了这种感觉控制的各个方面,例如,蟑螂(Mu and Ritzmann, 2008a, 2008b)和蝗虫(Knop et al., 2001; Zill, 1985)中运动反馈的作用。关于已知的感觉到中枢影响的性质及其在建立腿部步进运动输出中的作用的详细说明可以在以前的评论中找到(Büschges, 2005; Büschges et al., 2008, 2011; Daun-Gruhn and Büschges, 2011; Ritzmann amd Büschges, 2007)。重要的是,基于神经生物学结果的整合了形态特征、肌肉特性和神经控制结构的三维动态模拟显示了已识别的生成单腿步进模式的机制的充分性(Ekeberg et al., 2004; von Twickel et al., 2011)。
重要的是要注意,我们对昆虫腿步进周期背后的神经机制的理解仍然存在重大差距:
1) 我们目前的大部分知识都涉及在单条中腿中直线向前迈步的产生。这种运动模式只发生在非常特殊的条件下,即当动物在水平面上行走时。此外,它只是昆虫腿可以产生的众多灵活混合运动中的一种。当我们考虑攀爬、垂直和倒立行走、越过障碍物、转弯或改变行走方向所需的腿部运动学变化时,这一点变得显而易见。与直线行走相比,所有这些行为中的腿部运动在运动学上明显不同(Dürr and Ebeling, 2005; Gruhn et al., 2006, 2009; Mu and Ritzmann, 2008a)。根据这里介绍的结果,可以想象它们可能取决于来自其他腿部感觉器官的感觉信号的不同影响。昆虫腿配备了迷人的本体感受器,其中许多对行走的作用尚不清楚。仅举几例,有发板、内部拉伸感受器和肌肉感受器器官(例如,Bässler, 1983; Bräunig et al., 1981; Burrows, 1996; Tuthill and Wilson, 2016)。
2)除了慢走的竹节虫之外,其他昆虫的腿踏步的产生是否也以类似的方式依赖于感觉反馈信号?这个问题源于在线感官反馈有一定的延迟。在快速行走的昆虫中,步进频率为20 Hz或更高,可用于执行摆动或站立运动的时间低于20-30毫秒。在这些条件下,当感觉激活、神经传导时间和肌肉纤维激活导致信号传输延迟时,从摆动到站立,或反之亦然的转变是否可以完全由感觉反馈产生,这变得值得怀疑(Guschlbauer et al., 2007)考虑在内。Mendes et al. (2013)为果蝇提供了有关此问题的数据,该数据显示了从小于1 Hz到大于18 Hz的广泛步进频率(Wosnitza et al., 2013a)。Mendes et al. (2013)通过在成年果蝇的大多数腿部感觉神经元中表达破伤风毒素轻链,使用腿部感觉器官的基因沉默。这导致腿部感觉投射的许多突触输出受到抑制。缺乏这种感觉反馈的苍蝇仍然能够在单条腿上产生踏步活动;然而,运动模式的可变性增加了。这些结果表明,在快速步行期间,单腿踏步的分段协调并不完全依赖于感官反馈。 其他中枢机制可能在协调肌肉活动方面发挥作用。
MOTOR FLEXIBILITY IN A STEPPING INSECT LEG: FORWARD AND BACKWARD WALKING, CURVE WALKING, AND SPEED CHANGES
当动物需要改变方向或行走速度时,昆虫腿的步进运动如何产生变化?这些是理解动物如何产生目标导向的运动行为的机制的关键问题。通过表征在产生调节预期行为结果的适当运动输出中感觉反馈的影响和处理的变化,在这方面取得了一些进展。虽然这些实验没有监测中枢回路中发生的活动,但运动神经元水平活动变化的时间和性质提供了对潜在机制的重要见解。
Forward vs. Backward Walking
我们将首先考虑从向前行走切换到向后行走的相对简单的任务。通过用刷子触摸其腹部,可以可靠地诱导竹节虫向前行走。可以通过触摸或拉动它的触角来引起向后行走。即使在系绳和部分减少的准备工作中,这种刺激诱发和特定方向的行走也能保持(Akay et al., 2007; Graham and Epstein, 1985)。两个方向之间的中间腿的运动输出的主要区别在于运动神经元的激活,这些神经元支配使腿向前和向后移动的肌肉,即量角器轴(ProCx)和牵开器轴(RetCx)运动神经元。与向前行走相比,这些肌肉以这样一种方式逆转它们的拮抗活动模式,即在向后迈步时,ProCx在站立时处于活动状态,而RetCx在摆动时处于活动状态。支配更远端关节肌肉的运动神经元的激活模式不会以这种依赖方向的方式改变(Rosenbaum et al., 2010)。在向前迈步时,RetCx运动神经元在站立时是活跃的;这是由通过转子上的CS介导的负载信号辅助的。当昆虫转为向后行走时,相同的负载信号会诱导拮抗ProCx运动神经元的活动。重要的是,已显示CS信号的影响作用于控制RetCx和ProCx运动神经元的CPG (Akay et al., 2007,另请参见图5)。在最近的一项研究中,Rosenbaum et al. (2015)研究了运动神经元在向前和向后步进的运动活动产生期间接收的突触驱动。尽管在运动系统激活后供应所有腿部关节的运动神经元接收的强直兴奋性突触驱动中没有检测到差异(Büschges et al., 2004; Schmidt et al., 2001),作者提出的证据表明,交替相兴奋性和抑制性突触驱动力对髋关节运动神经元具有独特的逆转作用,即RetCx和ProCx运动神经元的阶段性兴奋性和抑制性突触驱动。这种转换会导致他们的活动逆转,从而导致站立阶段方向的变化。除了负载信号之外,来自腿部的运动信号也已被证明有助于改变所有腿部后退所需的电机输出。Hellekes et al. (2012)表明,来自fCO的屈曲信号对控制前腿和后腿股骨-胫骨关节的运动神经元和肌肉的活动产生依赖于行走方向的影响。
Curve Walking
当动物从向前行走变为向后行走时,所有腿的运动输出都必须以类似的方式改变;如上所述,只需要改变站立运动神经元活动的确切阶段。当我们考虑曲线行走时,情况更加复杂。在昆虫中,曲线行走是由腿部运动学的身体侧特定变化引起的。曲线内侧的腿将动物拉向运动方向,而外侧的腿则将动物推向新的航向方向(Dürr and Ebeling, 2005;Jander, 1985)。与大多数其他动物一样,系留竹节虫可以通过使用其视野中呈现的视觉光运动刺激来诱导转动(Gruhn et al., 2009)。为了研究曲线行走中涉及的中心机制,可以通过让系绳昆虫在光滑的表面上行走来机械地使腿相互分离。在这些条件下,转弯内侧的腿在站立期间显示出强烈的胫骨弯曲,而外侧的腿在站立期间几乎没有弯曲(Gruhn et al., 2009)。这再次表明,来自运动和负载传感器的感觉信号的任务相关处理在以身体侧依赖的方式为曲线行走生成适当的腿部运动和运动学方面起着重要作用。Hellekes et al. (2012)提供了来自股骨CO的屈曲信号对运动输出的身体侧特异性适应的贡献的证据:尽管屈曲信号有助于曲线内侧腿部正在进行的屈肌运动神经元活动,但对于曲线外侧的腿,这种影响的频率降低了。Gruhn et al. (2016)表明,来自中腿的负荷反馈信号具有身体侧相关的影响:在曲线外侧,负荷信号启动并维持RetCx活动,而在曲线内侧,没有负载反馈信号的系统影响是可检测的。同样,这些不同的影响是基于感觉反馈,影响CPG的活动,甚至诱导相位切换,CPG有助于产生腿步进的电机输出。
Speed Changes
步行速度的变化是由单腿运动学的变化产生的,主要是它们的踏频,以及腿间协调的变化。 我们将首先考虑影响步进频率的那些机制的知识。 目前,有两条证据表明昆虫腿的步进频率的变化是由感觉反馈增益的改变引起的; 可能不涉及直接影响 CPG 的途径。 贝伦德斯等人。 (2016) 最近表明,在果蝇单腿截肢后,剩余的残肢以恒定且相对较高的频率振荡。 至关重要的是,这与步行速度和剩余完整腿的踩踏频率无关。 这些发现表明,来自大脑的下行信号对步行期间活跃的节段 CPG 没有或几乎没有控制。 其次,Gabriel 和 Büschges (2007) 已经表明,在竹节虫半完整的踏步腿中,只有到站立运动神经元的阶段性去极化突触输入量才会影响踏步速度的变化。重要的是,突触驱动的改变发生在持续的站立活动期间,并且在站立运动神经元的摆动期没有检测到突触输入的变化。 此外,摆动运动神经元的峰电位和谷电位没有发生变化。 这些发现得到了相关运动前中间神经元活动分析的支持(Rosenbaum 等人,2015 年;von Uckermann 和 Büschges 2009 年)。综上所述,这些发现表明,感觉反馈通路可能是控制昆虫行走速度的下行影响的目标。
INTERSEGMENTAL COORDINATION
如前所述,在昆虫中行走需要参与这种行为的所有六条腿之间适当的空间和时间协调。 对此以及底层机制的高级描述可以用术语“跨部门”或“跨部门协调”来概括。 行走时,每条腿执行摆动和站立动作的循环踏步行为; 单个腿的步进循环必须相互协调,以产生能够可靠地推动动物穿越其环境的整体活动模式。 不言而喻,有些腿间协调模式比其他模式更适合这种情况:例如,用所有六条腿同步执行摆动动作,会导致动物翻滚。 除了这些以稳定性为中心的基本考虑之外,腿间协调必须引起和适应步行速度和航向的变化,从向前行走到向后行走的切换,以及不同基材的变化,甚至必须考虑到一个或多个意外或故意的损失。 腿(马金尼斯 2006 年)。 一般来说,有两种机制可能有助于协调多条腿的规律活动:所涉及的 CPG 和感官信号之间的直接耦合,传递有关一条腿当前所处状态的信息。
下面,我们将首先简要总结当前关于行为层面的跨腿协调的知识。 然后我们将讨论中央耦合对协调的贡献。最后,我们将概述腿间协调规则的感官依赖性质及其假定的神经基础。
Behavioral Aspects of Interleg Coordination
昆虫的基本(向前)行走行为包括身体两侧的三个同侧腿的连续伸展。 这种异时性的活动波总是指向前方:在后腿伸展后,同侧中腿伸展,接着是前腿伸展,然后重复循环。 这在身体两侧都可以观察到,除特殊情况外,似乎是昆虫行走中相对严格的不变量; 然而,两个对侧异时波之间存在相位差。 综合起来,这两个异时的活动波构成了正常的步行行为。
在昆虫行走的文献中已经描述了几种协调模式(通常也称为步态)。 在低速行走时,昆虫表现出一种腿间协调模式,最清楚地说明了同侧腿前伸的异时性。 有时称为“波浪步态”,这种协调模式的特点是站立时间非常长(Hughes 1952)。 结果,在给定时间最多有一条腿执行其摆动运动。 在中等步行速度下,昆虫使用协调模式,在这种模式下,最多同时抬起两条腿(Graham 1972)。 这种协调模式称为“四足协调”,指的是至少有四条腿始终与地面接触。 同侧腿的前伸异时波保持在这种协调模式中。 但是,单条腿的站立时间较短; 因此,对侧身体两侧的两条腿的摆动动作可以重叠。 身体两侧之间的相移确保同一节段的两条对侧腿不会同时执行其摆动阶段。 最后,在高速行走时,昆虫会使用一种称为“三脚架协调”的协调模式(Graham 1972;Strauss 和 Heisenberg 1990;Wahl 等人,2015 年;Wosnitza 等人,2015 年)。2013a)。 正如该术语所暗示的那样,在任何给定时间,至少有三条腿在地上。 引人注目的是,两组每组三条腿(前腿、同侧后腿和对侧中腿)同步进行摆动动作,两组交替出现180°的相位差。在三脚架协调期间,站立运动的持续时间变得更短,与摆动运动的持续时间相似,甚至在飞速奔跑的昆虫中甚至更短(Wahl 等人,2015 年)。 结果,拖延的异时波不再清晰可见,因为单腿的步进频率高于异时波的频率。 三脚架协调通常被认为是昆虫一般使用的典型协调模式。 尽管许多昆虫主要使用三脚架协调,这可能是事实,但对三脚架协调性观察有偏见的一个原因可能是基于这样一个事实,即许多调查行走期间腿间协调的研究都是针对快速行走的昆虫进行的,例如 蟑螂。 但即使对于通常跑得很快的蟑螂和速度最快的昆虫中的沙漠蚂蚁,也有强有力的证据表明它们在以较慢的速度行走时会使用其他腿间协调模式(Bender 等人,2011 年;Wahl 等人,2015 年) )。
Central Aspects of Interleg Coordination
对不同昆虫物种的几项研究为参与行走的 CPG 之间的直接联系提供了证据。 正如 CPGS 作为在昆虫中行走的腿部肌肉控制系统的一部分的证据中所述,这些研究利用了昆虫的腹侧神经索很容易被切断的事实,从而消除了所有潜在的感官影响,并允许调查 不同神经节中 CPG 之间的潜在直接联系。此外,已经发现,例如,在这些制剂中,可以通过应用毛果芸香碱(一种毒蕈碱胆碱能激动剂)来引起规律性运动输出、降压/提肌运动系统的交替活动(Ryckebusch 和 Laurent 1991)。 由此产生的运动输出通常被称为“虚拟运动”。 总的来说,这些研究总是发现昆虫中存在规律网络之间的直接联系。 然而,这些耦合建立与跨腿协调相关的功能性运动模式的程度各不相同。
Johnston 和 Levine (2002) 研究了在应用毛果芸香碱后天蛾(Manduca sexta)的传入神经系统中虚构的运动模式(图 1)。3A)。 他们从支配所有同侧神经节的提肌和压肌的神经进行记录。 这些肌肉是拮抗肌,以交替方式活跃。 在完整的动物中,提肌和压肌之间的活动转换发生在摆动后期,即腿放低到地面时,或在站立后期,腿开始抬起时(图 2)。 这项研究不仅发现驱动单腿拮抗肌的运动神经元池产生交替的运动输出,而且还提供了证据表明所有三个同侧半神经节的输出是协调的:前胸神经节的提肌运动输出与 后胸神经节; 同时,中胸神经节的降压运动输出活跃。 对于前胸和后胸压肌以及中胸提肌观察到相同类型的协调。 一般来说,这种虚构的协调模式表明个体神经节中的规律网络之间存在直接的中央联系; 此外,它类似于在完整动物的三脚架协调过程中所预期的。 在蟑螂(美洲大蠊)中,情况似乎类似(图 3B)。 传入聋和毛果芸香碱激活的蟑螂制剂倾向于产生虚构的运动模式,类似于实际行走过程中发现的三脚架协调(Ayali 等人,2015 年;Fuchs 等人,2011 年)。
对蝗虫和竹节虫的研究支持与步行相关的 CPG 之间存在直接联系的观点。然而,与天蛾和蟑螂的发现相反,蝗虫和竹节虫的假定联系不会产生类似于完整动物腿间协调的运动输出。 克内贝尔等人。 (2017) 同时记录了毛果芸香碱诱导的蝗虫 (Schistocerca gregaria) 抑制运动神经元传出的活动,无论是在所有同侧半神经节中还是在对侧半神经节中。 有趣的是,他们发现所有三个半神经节的同侧抑制运动神经元倾向于同时或同相激发(图 3C)。 在前胸神经节和中胸神经节的对侧半神经节(左右协调)的节内活动也发现了相同的一般趋势。 只有后胸侧半神经节有交替破裂的趋势。 在竹节虫 (Carausius morosus) 中进行的一项类似研究 (Mantziaris et al. 2017) 发现基本相同:同侧抑制运动神经元池具有同相活动的趋势(图 3D)。 同一节段的对侧抑制运动神经元也是如此。 在蝗虫和竹节虫中,在毛果芸香碱存在下观察到的中央生成的虚构运动模式不构成在行走期间在完整动物中观察到的功能性腿间协调模式。
总之,这些研究通常表明,至少一些参与步行的 CPG 之间存在直接联系,主要是不同腿的压肌/提肌运动系统。 这些研究中的另一个普遍发现是,与完整动物相比,协调性具有更高的可变性。 在天蛾和蟑螂中,由这些耦合产生的运动模式甚至与在完整动物中观察到的协调模式(主要是三脚架)有相似之处。 另一方面,蝗虫和竹节虫的传入神经系统不会产生类似于协调行走的活动模式。 此外,即使在天蛾和蟑螂中,虚构的运动输出似乎也是一种固定的、偏好的模式; 相比之下,已知完整的昆虫,尤其是蟑螂,能够使用其他协调模式(Bender 等人,2011 年)。 这些考虑提出了一个问题,即如何实现与行为相关的功能性跨腿协调(在蝗虫和竹节虫中)或如何灵活地适应(在天蛾和蟑螂中)。
Interleg Coordination Rules
大量的研究,主要是在竹节虫中,已经调查了可能引起昆虫腿间协调的行为机制。 尽管有证据表明单个关节的基本运动输出受 CPG 样神经结构的强烈影响,并且单个 CPG 可能通过直接连接弱耦合,但这些研究表明,腿部之间的协调强烈依赖于感觉信号。 与腿间协调直接相关的感觉信号主要源自腿部的感觉结构,例如毛发区域和行、脊索器官(Field 和 Matheson 1998)和钟状感受器(Zill 等,2004)。此外,这些信号似乎主要在直接相邻的腿之间活跃,即同一段的相邻同侧腿或对侧腿。 基于这些研究,一小组相对简单的行为规则已被证明足以协调六足步行(图 1)。4)。 有时,这些规则被归入“Cru(i)se 控制”这一术语,以暗指 Holk Cruse,他是许多相关研究的合著者(更多评论参见,例如 Cruse 1990; Cruse et al. 2007; Dürr et al . 2004)。 这些规则中的大多数确保腿之间的适当时间协调,而一个规则促进空间协调。 在下文中,我们将简要描述对跨段协调很重要的六项行为规则中的五项(规则 6 将不再讨论,因为它相对专业)。
规则 1. 该规则是一条时间规则,在同侧腿之间,即后腿和中腿之间,以及中腿和前腿之间在前方向上有效(克鲁斯和爱泼斯坦 1982 年;格雷厄姆 1978 年)。 规则 1 规定,当一条腿被抬起时,即在其摆动运动期间,相邻的前目标腿的抬起被抑制,并且该目标腿的站姿运动被延长。
规则 2。此时间规则在同侧腿之间和同一节段的对侧腿之间的前向方向上有效(Cruse 和 Knauth 1989;Cruse 和 Schwarze 1988)。 规则 2 规定,当一条腿着地时,即在其伸展结束时,它有助于相邻目标腿开始伸展。
规则 3。此时间规则在同侧腿之间和同一节段的对侧腿之间的向后方向有效(Cruse 和 Knauth 1989;Cruse 和 Schwarze 1988)。 在正在进行的站姿运动期间,如果相邻目标腿尚未开始摆动运动,则会对其产生影响。 前腿越接近其抬起位置,这种影响的强度就越大。
规则 4。该规则负责空间协调,并在同侧腿之间的后向方向上活跃(Cruse 1979;Dean 和 Wendler 1983;Wosnitza 等人 2013b)。 一条腿当前的跗骨触地位置会影响直接后腿的预期触地位置; 该规则充当中腿和后腿、前腿和中腿之间的瞄准机制。
规则 5. 该规则不是专门作用于单个腿对之间,而是更多的全局协调规则:当一条腿的负荷增加时,所有其他腿的站立时间都会延长,从而调整力量以保持动物的身体抬起 (克鲁斯 1985 年;施密茨 1993 年)。 例如,由于行走过程中腿部正常抬起,随后支撑腿的数量暂时减少,或者在腿部完全丧失后负荷普遍增加,可能会发生这种效果。 为清楚起见,图 4 中的示意图省略了该规则。
需要注意的是,在它们最初的表述中,所有这些规则本质上都是局部的; 即,它们的影响在相邻(同侧或对侧)腿对之间是活跃的。 在这个概念中,步行过程中所有六条腿的整体协调是双腿之间协调的一个紧急属性。此外,这些协调规则被认为是基于在腿之间连续传递的敏锐感觉信息。 因此,他们能够考虑由于基板可变性导致的外部扰动,例如,或降低电机输出精度的一般电机噪声。 结合 CPG 活动提供的基本运动输出,这些感官影响能够将单条腿的有规律的步进塑造成一个协调的整体。
Sensory Mechanisms for Interleg Coordination
如上一段所述,介导腿间协调的神经信号被认为主要是自然界中的感觉信号,起源于行走昆虫腿部的几个感觉器官。 其中包括脊索器官(Field 和 Matheson,1998 年)、毛发区域和行,以及钟状感器(Zill 等人,2004 年)。 前两种感觉结构(脊索器官和毛发区域/行)测量腿部运动的运动学方面,即位置、速度和加速度,而钟状感受器对腿部受力时发生的表皮应变作出反应。 所有这些结构都是促进腿间协调的神经信号的推定来源,事实上,至少在原则上,已经证明具有段间影响。 我们简要回顾了一些研究,这些研究表明这些感觉结构与跨腿协调的相关性。 然而,必须指出的是,关于神经通路的明确信息和感觉信号对腿间协调的具体贡献仍然很少。
斯坦等人。 (2006) 刺激竹节虫中间腿的股骨脊索器官 (fCO),同时监测其他几条腿负责胫骨伸展和屈曲的运动神经元的活动。 他们的结果表明,这种感觉刺激对记录在对侧中腿的运动神经元有明显的影响,其尖峰活动跟随施加的刺激。 此外,应用苦味毒素来降低对中枢神经系统的一般抑制作用表明,这种刺激锁定反应存在于所有腿中,表明源自中腿的急性感觉信息传递到所有其他腿。 然而,目前尚不清楚这些结果与步行的关系,因为他们使用的准备工作在很大程度上是聋哑的,从而消除了受影响腿部的感觉信号。
为了表征间腿靶向的神经元基础(规则 4;见上文),Brunn 和 Dean (1994) 在移动同侧中胸段腿时记录了后胸神经节中间神经元的神经元活动; 这项研究的目的是在与目标腿相关的神经节中找到与目标信息相关的神经关联。 先前的研究(Cruse 等人,1984 年;Dean 和 Wendler,1983 年)已经将头发区域和行以及股骨脊索器官作为用于定位的这种感觉信息的来源。 事实上,这项研究发现了几个投射到后胸神经节的中间神经元,以及一个对中腿当前姿势的变化做出系统反应的局部中间神经元。 有趣的是,这些神经元的反应可以解释为中腿关节角度的神经表示,而不是外坐标中跗骨位置的表示。
路德瓦尔等人。 (2005) 研究了前腿 fCO 对竹节虫中胸廓伸展/收缩运动神经元以及伸肌/提肌运动神经元输出的影响。 在这项研究中,除了固定的前腿残端的感觉结构外,动物完全没有传入神经。在中胸运动神经元的短暂交替活动期间,前腿 fCO 被拉长,模仿这条腿的屈曲。 这种 fCO 刺激促进了同侧中胸运动神经元的屈肌和牵开活动,表明源自 fCO 的感觉信号的节间影响。 至关重要的是,在同一项研究中,完全去传入神经的制剂在毛果芸香碱诱导活动期间没有显示相同运动神经元之间的节间耦合。
Ludwar 等人显示的结果。 (2005) 得到了最近在蟑螂中的发现的支持。 在他们的研究中,Fuchs 等人。(2012) 使用外部施加在前腿和后腿上的运动,并研究了这些刺激对毛果芸香碱在中胸传出神经中诱发的虚构运动规律的影响。 类似于 Ludwar 等人的研究。(2005),他们发现前腿或后腿运动对中胸提肌传出神经活动的影响被强加的规律所夹带。 此外,夹带是频率相关的,即完整腿的运动频率决定了虚构运动规律的频率。
本节迄今为止概述的研究调查了与位置信息相关的感官信号,即像头发板和 fCO 这样的传感器。 钟状感受器 (CS) 也可能参与跨腿协调,但以更间接的方式参与。 齐尔等人。 (2009) 在自由行走的蟑螂中表明,一条中腿的卸载引起了这条腿胫骨 CS 的强烈活动。 令人惊讶的是,观察到的卸载不是由中腿摆动运动的开始引起的,正如人们所预期的那样,而是由后腿的触地和站立运动的开始引起的。后腿的触地得分承担了动物的一些体重,从而减轻了中腿的重量,进而导致卸载。 中腿胫骨 CS 的活动可能会促进抬升。 这种优雅的机制部分依赖于腿之间的机械相互作用,而这些相互作用是由感官结构在局部获取的。
在结束本节时,必须指出,在行为层面上,关于行走昆虫的腿间协调有很多了解。 这导致制定了一小组分散的协调规则,这些规则已在 WalkNet(例如,Cruse 等人,1998 年;Schilling 等人,2013 年)和步行机器人(例如,Schmitz 等人,2013 年)等模拟中得到证明。 2008)足以进行适当的和类似昆虫的跨腿协调。关于这些规则背后的神经机制和结构,情况不太清楚。 关于中枢和感觉过程之间的相互作用以及感觉信号如何塑造基本的规律输出,有几条信息。 然而,关于行走过程中腿间协调的神经水平的连贯、全面和综合的观点仍然难以捉摸。 目前所有关于神经过程的发现都基于减少的准备工作,其中只研究了孤立的方面。本综述中讨论的许多发现都在实验中进行了研究,在这些实验中,动物已被药理学激活,或者只有几条腿,甚至一条腿实际上表现出类似于步行的行为。 例如,为了更全面地了解克鲁斯规则如何在神经元上实施,完整的步行准备是必要的,另一方面,允许同时记录和刺激 CPG 神经元、感觉神经元和中间神经元。 这将使研究人员回答一些问题,这些问题解决了规律网络之间的直接中央耦合和腿部通过感觉信号(例如通过机械耦合)介导的更间接耦合的个体贡献。
DESCENDING CONTROL OF MOTOR OUTPUT IN INSECT WALKING
尽管产生协调的六足动物行走的大部分神经机器都位于昆虫神经索中,但来自大脑的下行输入有助于启动和操纵这些神经元,从而实现目标定向运动。 降序控制的原理似乎与脊椎动物有相似之处(Orlovsky 等,1999)。 然而,在行走的昆虫中,关于运动的下行控制和贡献下行神经元通路(即启动、维持、方向控制和停止)的细节的知识仍然非常有限(例如,Bidaye 等人,2006 年)。2014; Böhm 和 Schildberger 1992; 马丁等人。 2015)。
下行神经元在步行控制中的重要性。 数百万年来,寄生宝石黄蜂(Ampulex compressa)对蟑螂受试者进行了一项最引人注目的“实验”,该实验显示了下降对昆虫行走的影响的重要性,并且具有非常高的可重复性。这些黄蜂是寄生虫,它们以活蟑螂的幼虫的形式孵化和进食。 母蜂进化出一种特殊的宿主控制机制,为其后代提供完美的营养来源(见 Libersat and Gal 2014;Libersat and Gal 2013)。 当寄生蜂遇到它的寄主蟑螂时,它会对蟑螂进行复杂的“手术”,包括快速刺到胸腔以暂时抑制寄主的腿部运动,然后以较慢且高度精确的机械感受器引导下将神经毒素注射到蟑螂的特定大脑区域。 蟑螂。 黄蜂毒素特别使蟑螂无法自主行走。蟑螂大脑中黄蜂毒液的放射性同位素示踪表明,毒液主要集中在颌骨神经节(以前称为食管下神经节,但参见 Ito 等人 2014)和一些更高的大脑区域,例如中枢复合神经元(Haspel 等人) 2003 年)。 在这次成功的宿主控制手术之后,黄蜂通过拉动它的触角将蟑螂引导到它的巢穴。 只有更高级别的控制信号会受到黄蜂毒液的影响,因此位于腹侧神经索中的局部控制回路,包括负责行走的 CPG,可能会响应黄蜂的牵引而发挥作用。 因此,黄蜂能够将行走的蟑螂一直引导到它的巢穴。 到达那里后,黄蜂会在宿主身上产卵并密封巢穴,以便其后代在受保护和营养丰富的环境中孵化。 如果实验者干扰这个过程并在孵化前取出黄蜂卵,蟑螂就能在几天后重新完全控制它的行走。 这表明黄蜂毒素特异性地和瞬时地使某些负责开始行走的大脑或颌骨神经节神经元失活。 事实上,研究人员现在已经通过将黄蜂毒液局部注射到蟑螂的不同大脑区域来重现这种效果,并表明将毒液注射到颌骨神经节区域或单独的中央复合体区域就足以诱发运动机能减退 在蟑螂。黄蜂可能会在多个区域注射毒液,以确保其宿主长期运动机能减退。 这些对黄蜂-蟑螂相互作用的观察清楚地证明了来自下颌神经节和大脑神经节区域的下行信号在控制行走开始方面的重要性。
除了开始行走外,下降信号对行走的停止和控制速度和方向也起着重要的作用。 此外,它们控制有助于产生腿踏的感觉运动影响。 后一种功能最近由 Martin 等人首次展示。 (2015),他提供了证据表明来自昆虫大脑中枢复合体的下行信号可以改变蟑螂行走系统中局部反射的迹象。 由于对下游 CPG 和局部回路的精确操纵(在前面的部分中描述过),以响应特定的环境和内部刺激,从而表现出大脑下行命令的所有这些功能。 为了充分理解昆虫行走的灵活性和适应性,必须首先了解感觉信息如何在下行中间神经元的活动中表示,然后了解这些活动模式如何改变由 CPG 和局部神经元组成的下游胸神经回路的输出。 和参与行走的节间神经元。 为此,研究人员要么记录下行中间神经元响应感官刺激的活动,要么通过实验操纵下行中间神经元的活动,并观察其对行走过程中行为或运动活动的影响。 在下面的段落中,我们回顾了在这个方向上提供见解的关键实验观察。
与黄蜂-蟑螂相互作用中的观察结果类似,对断头和去脑(宫颈结缔组织病变)昆虫的早期研究表明,来自下行输入的信息对于自主行走至关重要。 这是通过对几种昆虫物种(包括果蝇(Yellman 等人,1997 年)、蟑螂(Ridgel 和 Ritzmann 2005 年)、竹节虫(Graham 1979 年)或 螳螂(Roeder 1937)。 这表明,在昆虫中,如在脊椎动物中 (Orlovsky et al. 1999),来自大脑的下行输入对于开启步行所需的 CPG 活动至关重要。 相比之下,食道周围结缔组织(较高大脑区域和颌骨神经节之间的连接)的压碎或损伤不会导致行走停止。 事实上,这些昆虫仍然能够表现出协调的三脚架间腿协调。 他们步行行为的唯一障碍似乎是缺乏适当的速度和方向控制。 这些观察表明,位于颚神经节中的中间神经元足以启动正常的向前行走,而较高大脑区域的下行中间神经元对于控制步行速度和方向可能很重要(Gal 和 Libersat 2006;Graham 1979;Ridgel 和 Ritzmann 2005 )。
Electrophysiological characterization of descending interneurons. 为了精确定位参与行走的下行中间神经元,研究人员记录了不同昆虫物种的几个下行中间神经元。 Böhm 和 Schildberger (1992) 在蟋蟀中发现了一个同侧下行中间神经元 (IDIN),其活动与步行开始高度相关。 此外,在电流注入时,该神经元导致行走开始,而在超极化时,它导致行走停止。 然而,作者指出,有几次动物在 IDIN 停止射击时继续行走。 这表明它不是维持行走状态所必需的。 尽管如此,IDIN 确实是一个非常有趣的电生理特征的下行中间神经元,它可能有助于开启下游神经索行走回路。 最近的另一项研究(Zorovic´ 和 Hedwig 2013)已经确定了蟋蟀中其他三个下行中间神经元,它们对听觉刺激做出反应,并可以在电流注入时诱导行走。 有趣的是,除了诱导行走外,这些神经元还诱导了旋转分量。 B-DI1(1) 是诱导同侧转弯的同侧下行中间神经元,B-DI1(2) 是诱导对侧转弯的同侧下行中间神经元,B-DC(5) 是诱导对侧转弯的对侧下行中间神经元。 然而,只有 B-DC(5) 导致在它被超极化时停止正在进行的行走。此外,作者指出,与自发尖峰诱发步行的潜伏期(30 至 50 毫秒)相比,所有三个神经元注入电流后开始步行的潜伏期要长得多(150 毫秒)。 这表明通常这些神经元可能会成群结队地工作,而不是单独负责行走的开始。 此外,它们对听觉刺激的反应表明,这些神经元可能对于将蟋蟀转向同种产生的啁啾刺激至关重要。 因此,这些神经元必须同时激活和调节下游局部回路。沿着类似的路线,响应触角触摸并涉及转向控制的神经元已在竹节虫(Ache 等人,2015 年)和蟑螂(Burdohan 和 Comer,1996 年)中得到表征。 然而,它们在步行控制中的确切作用尚未确定。
下行中间神经元的这些电生理特征提供了关于通过头部感觉器官接收的感觉信息如何在单个下行中间神经元的活动中编码的重要信息。 这将极大地有助于了解特定刺激如何驱动昆虫行走模式的特定变化。然而,从许多记录实验中可以看出,通常多个下行中间神经元对类似的刺激做出反应,为了充分了解如何实现自然主义的目标导向步行,可能需要同时记录多个中间神经元。 此外,要了解下行中间神经元的活动如何转化为局部 CPG 生成的步进模式和节间协调模式的变化,有必要在操纵下行中间神经元的活动时记录这些下游神经元的活动。 此类实验将需要可重复访问相同的下行中间神经元。 虽然对这些神经元的电生理学访问提供了一种强大的方法来记录和操纵神经元活动,但这种技术并不总是允许对相同识别出的神经元进行可重复的实验。 生理学家使用解剖标志将他们的电极引导到昆虫大脑中的特定部位,然后在记录后对神经元进行染料填充以捕获它们的完整形态。 在某些情况下,电池的独特形状、位置和电特性有助于对同一电池的可重复访问; 然而,对于昆虫中枢神经系统中的神经元,这很少是真的。 这使得在给定的研究中很难有多个记录,其他实验室或未来研究的研究人员更难以复制和建立在现有结果的基础上。下行神经元的遗传靶向突出了以可靠方式实现这一目标的基于遗传学的策略。
Genetic targeting of descending neurons. 对神经元的遗传访问不仅克服了用电极物理靶向中枢神经元的障碍,而且还提供了一种可重复靶向的方法,从而使多个实验室的未来研究能够成功重现原始结果,甚至进一步表征神经元。 然而,与电生理技术相比,遗传靶向技术的复杂性和用于神经元操作和活动成像的神经遗传试剂的发展是最近才出现的。 截至目前,大多数基因靶向工作都集中在高度探索的基因模式昆虫 Drosophila melanogaster 上。获得果蝇中枢神经元遗传通路的主要方法是通过二分 GAL4/UAS 系统(Brand 和 Perrimon 1993)。 该系统(在 Hampel and Seeds 2017 中综述)依赖于酵母转录激活因子 GAL4 在特定神经元亚群中的基因组增强子控制表达。 当 GAL4 表达与另一种转基因的存在相结合时,效应蛋白在 GAL4 特异性上游激活子序列 (UAS) 的控制下,GAL4 靶向神经元也将表达效应蛋白。 目前,只有一例特定的基因靶向下行中间神经元与昆虫行走有关。
比达耶等人。 (2014) 使用神经激活 GAL4 屏幕在步行环境中搜索潜在有趣的基因靶向神经元。 屏幕依赖于使用新创建的 GAL4 库(Vienna Tiles GAL4 集合,VT-GAL4),该库针对苍蝇整个 CNS 中特定和稀疏的神经元群(Bidaye 等人,2014 年;von Philipsborn 等人,2011 年; Dickson BJ,未发表的意见)。他们使用最近发现的热生成激活试剂 UAS-TrpA1(Hamada 等人,2008 年)跨越了该系列的 GAL4 驱动线。 这种方法导致 TrpA1(一种热敏阳离子通道)在目标神经元群中表达,然后可以通过提高化验室的温度来去极化。 通过这种方式,作者筛选了 3,400 多个不同的 GAL4 系,发现了一个特别有趣的系,称为“moonwalker”。 在热生成激活时,这条线的苍蝇进行连续的长时间向后行走。 涉及 split-GAL4 系统的进一步交叉遗传方法(Luan 等人,2006 年;Pfeiffer 等人,2010 年)使作者确定了一个特定的下行中间神经元,称为“moonwalker 下行神经元”(MDN)。 该神经元足以在激活时启动向后行走(图 5C)。 此外,通过基因表达破伤风毒素轻链 (TNT) 使该神经元沉默,使果蝇在试验中失去了向后行走的能力,在这种试验中,对照果蝇更喜欢在机械受限的环境中向后行走。这表明 MDN 是开始倒退行走的必要和充分条件。 此外,这意味着对 MDN 输出的有针对性的调查将提供有关如何启动倒退的更详细信息。 MDN 诱导的倒退导致每条腿从向前迈向后退。 在步进昆虫腿的运动灵活性:向前和向后行走、曲线行走和速度变化中,我们讨论了在竹节虫中天线拉动引起的向后步进涉及 ProCx 和 RetCx 运动神经元上的相位输入的切换(图 2)。 5A 和 5B),与向前行走相比。 MDN 激活很可能在飞行中每条腿的局部电路中引起类似的转换。 有趣的是,对“月球漫步”果蝇的步进模式的量化表明,除了将每条腿的运动从向前步进切换到向后步进之外,MDN 还切换了腿间协调顺序。后向步态通常速度较慢,通常具有反向异时波(同侧前中后序)。 这表明同一下行中间神经元的活动能够实现两种不同的功能:单腿步进方向的切换和腿间协调的变化。 腿间协调开关是否是由后退腿引起的感觉反馈改变的副产品,或者它是否是对中央节间协调神经元的直接操纵仍然未知,但对 MDN 的遗传访问确实提供了规划这种假设驱动的未来的方法 学习。 事实上,在使用遗传工具靶向 MDN 神经元的后续研究中,Sen 等人。 (2017) 成功地表明,这些神经元接收来自迫在眉睫的敏感视觉投射神经元的输入。 同样,研究 MDN 输出如何影响腹侧神经索 CPG 回路的研究正在进行中,并将提供进一步的机制洞察力,了解该神经元的活动如何转化为步行方向的变化。 除了 MDN,作者还在原始月球漫步者系列中发现了一个上升神经元,即“月球漫步者上升神经元”(MAN)。 该神经元有助于维持长时间的后退行走状态,这是月球行走表型的典型特征。 通过对单独靶向 MDN、单独靶向 MAN 以及 MDN 和 MAN 的遗传试剂的神经激活和失活数据的仔细量化,作者得出结论,MAN 不是向后启动所必需的,而是抑制竞争性向前行走驱动,从而延长向后行走状态 当与 MDN 共同激活时。 因此,对 MAN 的遗传访问为寻找参与向前行走的中间神经元提供了一个潜在的非常有用的工具。
SOME NEXT STEPS IN UNDERSTANDING THE CONTROL OF INSECT WALKING
根据我们在本综述中概述的内容,我们现在可以总结昆虫如何为六足行走产生协调运动输出的一般示意图。 每条腿在踏步过程中产生站姿和摆动动作的规律活动源于中央神经网络(即所谓的 CPG)的规律活动。 模块化 CPG,每个都驱动一个腿关节的拮抗肌,协同产生单腿迈步所需的运动输出。 这种运动活动的幅度和时间由源自腿部感觉结构的特定反馈信号修改和协调。 这些包括有关运动、力或负载以及地面接触的信息。 在一些快速行走的昆虫中,例如蟑螂,模块化 CPG 之间的中央耦合也可能有助于协调运动输出,但感觉反馈明显减少。 通过下行中间神经元传递的来自大脑的下行输入对于胸神经节 CPG 活动的启动和调节运动输出都很重要,以产生适合目标导向行走的不同腿部运动。 目前的证据表明,下降输入的影响是特定于关节的,并且会改变感觉反馈如何影响该关节的 CPG 输出。
各种建模方法表明,CPG、来自腿的感觉信号和腿之间的协调影响之间相互作用的一般思想能够充分捕捉昆虫中步进和行走的基本特征(Daun-Gruhn 2011;Ekeberg 等 al. 2004;Szczecinski 等人 2014、2015 年;Toth 和 Daun-Gruhn 2011 年;von Twickel 等人 2011 年)。 这些模拟中使用的电路设计在一定程度上解释了许多可用的行为和运动记录数据,并为电路机制提供了概念见解和特定假设。 托特等人。 例如,(2012) 创建了一个单条中间腿的神经力学模型,用于模拟从向前迈步到向后迈步的转换。 为了解释从行为上观察到的向前和向后步进之间的快速切换,他们在模型中的 CPG 和运动神经元之间引入了两层中间神经元。 使用这种配置,负责向后步进切换的下降输入在 CPG 的下游点起作用,从而在步进方向上引起几乎瞬时的切换,类似于在行为昆虫中经常观察到的情况。 这为未来研究的方向选择机制提供了一个可检验的假设。 目前,这些模拟存在一些缺点,需要进一步的实验数据以及更详细的建模。 首先,感觉反馈信号的实现通常要简单得多,也没有生物系统中已知的那么完整,例如,当运动和力信号结合到单个感觉状态变量时(例如,Toth 和 Daun-Gruhn 2011 ; Tóth 等人,2012 年)。 此外,模拟被迫对步行回路中的所有中枢神经元(CPG、前运动中间神经元、节间神经元和下行中间神经元)做出主要假设。大多数中枢神经元是未知的,要真正了解中枢转换,必须识别和表征该回路中的中枢神经元。 最后,如上所述,目前对于在昆虫协调行走行为的产生过程中网络拓扑结构间和下降信号如何以及通过哪些影响节段网络和 CPG 知之甚少(评论见 Ayali 等人 2015;Borgmann 和 Büschges 2015 )。 解决这些问题可以使模拟研究更具洞察力,事实上,可以推动新假设的制定,以阐明电路功能的核心原理。
对大型昆虫的电生理学方法在该任务中可能会有所帮助,因为它们允许预先减少步行系统,从而简化步行系统。此外,这些方法使得在对已识别神经元进行单细胞记录的同时,通过对腿部感觉器官的体内样刺激,精确定位腹侧神经索中的信息处理成为可能(例如,Zill 等人 2015 年、2017 年)。 同样,它们允许将六足动物减少为单足或两足动物,从而在执行踏步行为期间排除来自相邻节段或腿的特定信息(Berg 等人,2015 年;von Uckermann 和 Büschges 2009 年) )。 然而,网络元素的识别可能受益于运动控制方法学的进步:虽然一些参与控制步行的中枢神经元已经被表征,但这些通常是不同昆虫物种的孤立案例。 这使得很难将它们全部放在一个电路图中。 此外,由于大多数具有特征的中枢神经元没有转基因驱动线,因此很难可重复地访问这些神经元以进行进一步研究。 基因靶向特定中枢神经元的能力确实为未来的大量研究开辟了道路,例如月球行者下降神经元的发现(上文概述;Bidaye 等人)。2014)。 除了可重复访问之外,基因靶向还使这些神经元能够适应光遗传学、热遗传学和钙/电压成像技术中越来越复杂的工具。因此,一些努力正在努力创建以 D 的大多数 CNS 中的特定神经元为目标的基因驱动线(尤其是分裂 GAL4 线)也就不足为奇了。黑腹。 事实上,Janelia 研究园区已经创建了一个针对果蝇所有下行中间神经元三分之一的大型资源(未发表的观察;Namiki S 和 Card G,个人交流;https://www.janelia.org/project-team /fly-descending-interneuron)。 也正在为腹神经索神经元创建类似的资源。 这些工具将极大地帮助识别果蝇行走回路中的中枢神经元。 然而,识别神经元只是第一步; 然后需要将这些放入解剖学和功能注释的电路图中。 果蝇整个神经系统的电子显微镜(EM)重建正在进行中; 最近的一份出版物显示了完整的大脑电子显微照片(Zheng 等人,2017 年),并且正在对腹侧神经索进行类似的 EM 研究。 这些电子显微镜数据对于重建步行电路的完整接线图非常宝贵。 尽管这些努力目前仅限于 D.melanogaster,在这个过程中优化的技术将有助于其他昆虫物种的类似分析。 以及。 此外,通过使用新开发的基于 CRISPR 的遗传学策略(Fineran 和 Charpentier 2012;Wiedenheft 等人,2012 年),现在可以在许多昆虫物种中创建转基因资源,例如蚊子(Kistler 等人,2015 年) 、蚂蚁(Trible 等人,2017 年)、蚕蛾(Wang 等人,2013 年)、蝗虫(Li 等人,2016 年)和蟋蟀(Awata 等人,2015 年)。 这一点尤其重要,因为一些研究,例如同时记录行为动物,实际上在更大的昆虫(例如竹节虫和蟑螂)中实施效果更好。 给定昆虫物种的行为谱也是有限的,因此,如果技术在几种模式昆虫中同时进步,则总是有益的。 这也可能使研究人员能够解决特定的行为专业化是如何产生的。例如,不同昆虫的行走速度范围有很大不同(竹节虫的平均行走速度比蟑螂慢得多),不同物种的神经回路特性可能有一些有趣的特化。 因此,最终,拥有多个昆虫物种的比较和特定数据集确实很有价值。



 浙公网安备 33010602011771号
浙公网安备 33010602011771号