SciTech-Physics-Particle-Quantum Theories-Spectrum(Light&Radio): 光谱(辐射/吸收) + Bohr(Denmark)的电子绕原子核的能级轨道及跃迁模型: 波粒双性 + 量子化的能量+频率
SciTech-Physics-Particle-Quantum Theories-Spectrum(Light&Radio):
Spectrum 光谱(辐射/吸收)
光谱是:
1.“复色光”通过“光学分光仪器(最常见的是棱镜)”分光,
2. 颜色(纯净的单色光成份)会散开成“光带”,
3. 这些“纯净的单色光成份”按照“波长或频率的大小有序排列的图样”.
就是“光谱”。
- 自然光谱:
彩虹: 太阳光经过空气中的“小水滴”分光后色散成的光谱(自然态)。 - 研究光谱:
三棱镜分光的光谱: 棱镜是最常用的分光仪。棱镜只能给出可见的色带。
光谱仪分光的光谱: 光谱仪是科学研究专业级的分光仪器。那光谱仪能给出每一种成份单色光的频率。
 |
 |
 |
|---|---|---|
 |
 |
彩虹是光谱 太阳光经过空气中的“小水滴”分光后色散成的光谱(自然态)  |
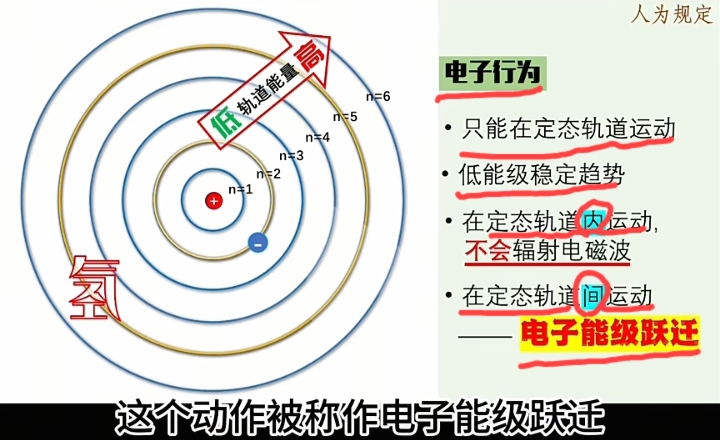
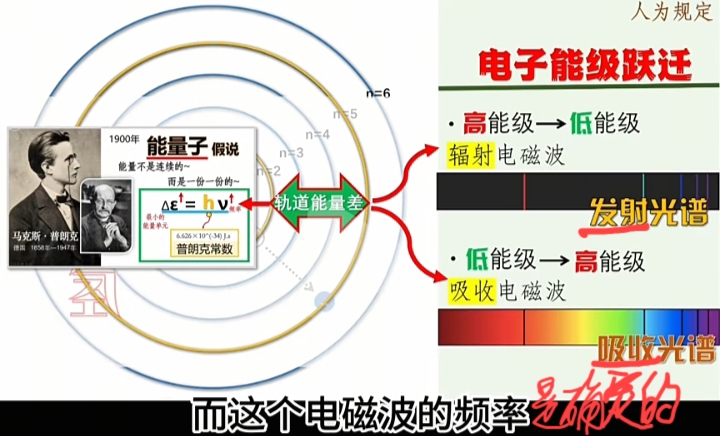
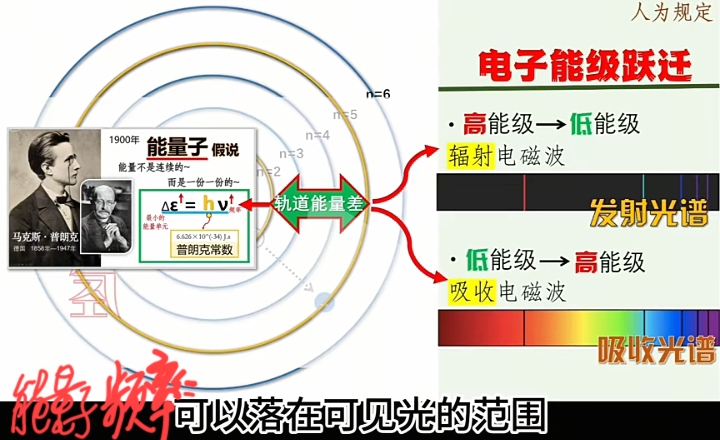
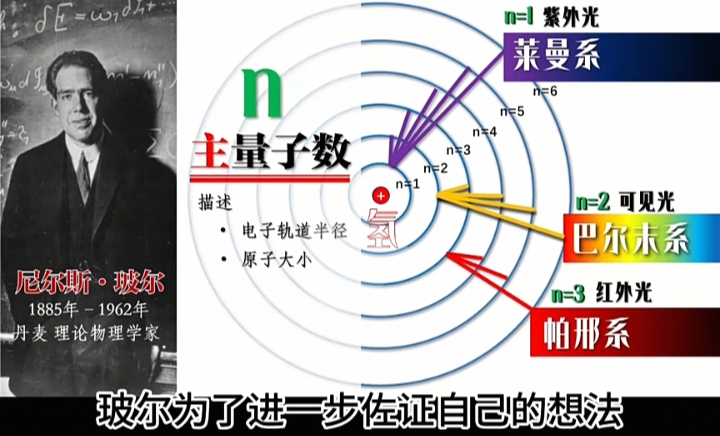
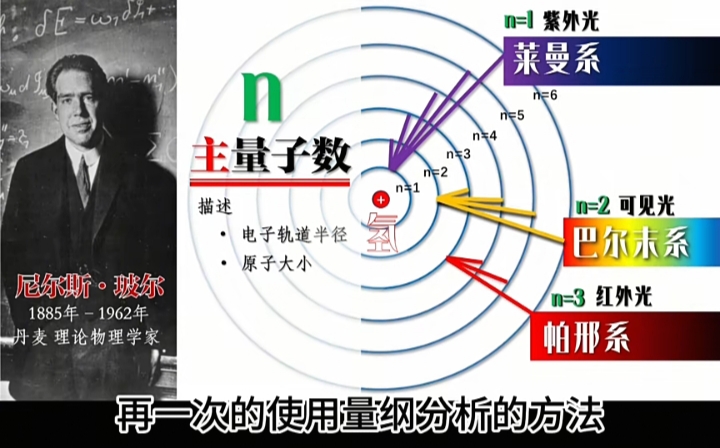
Bohr的电子绕原子核的能级轨道及跃迁模型:
电子轨道
- 多条的,圆的: 空间分布用“波函数”
描述。
每一条轨道都有其确定的能量状态。 - 离散的: 不是连续的,波函数上有"峰谷"。
- 定态的:
- 基态: 有且只有一条"基态轨道",能量最低的,也是最常见的状态。
可有 "唯一标识性的" 其它多条"更高能级"稳态轨道。
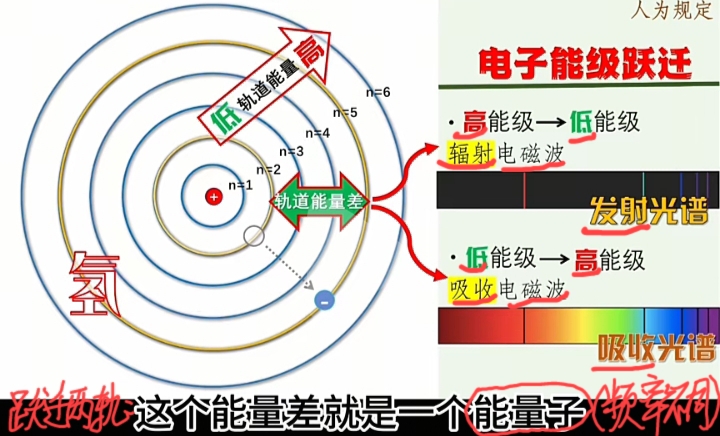
在"不变换的定态轨道"上的运动电子是"能量稳定的",不会发射或吸收能量子。 - 激发态: 能量跃迁,
在"定态轨道之间变迁"时的运动电子是"能量不稳定且瞬态的",会发射或吸收能量子。
大多数场景是在“基态轨道”与"其它非基态轨道"之间“跃迁”。
也有"非基态轨道"之间的跃迁(例如人为科学的能量控制: 恒温、升温、降温)
- 基态: 有且只有一条"基态轨道",能量最低的,也是最常见的状态。
- 轨道半径越小,能量越低,运动状态越稳定(出现概率越高,因为熵增定律)。
轨道半径越大,能量越高,运动状态越不稳定(出现概率越小).
每一种原子都有一条确定的半径最小的基态轨道, 能量最低最稳定.
原子的基态轨道的唯一与确定 是由原子本身决定的。
波粒双性
对每一种原子,其 每条轨道(半径、能量级)都是确定的,而且每条轨道都有其确定的能量状态..
注意:
- 对确定的一种原子, 其"每条轨道的能量级" 及 "所有轨道的空间(半径)分布" 是确定的。
- 每种原子的原子核不同: 其 "每条轨道的能量级" 及 "所有轨道的空间(半径)分布" 都不同。
元素周期表上的每一种原子都有其"特征光谱", 这是通过"光谱"确定"物质成份"的科学根据。
是因为: 对每一种原子:
- 核外的"每一个电子"是相同的,
- 原子核(质子、中子及它们的结构)是不同且唯一的(元素周期表的排序依据)。
 |
 |
 |
|---|---|---|
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
最终结果
Bohr(Denmark)发表三篇划时代的论文

 |
 |
 |
 |
|---|---|---|---|
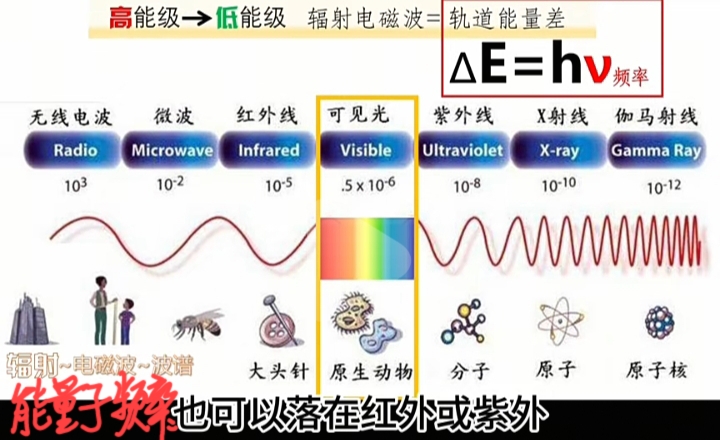
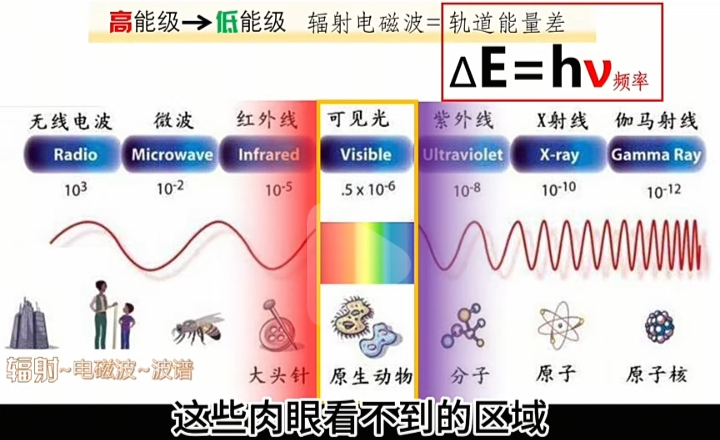
量子化的能量VS频率
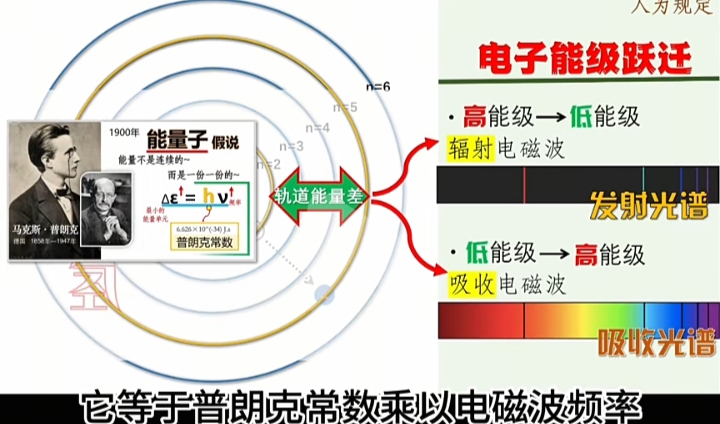
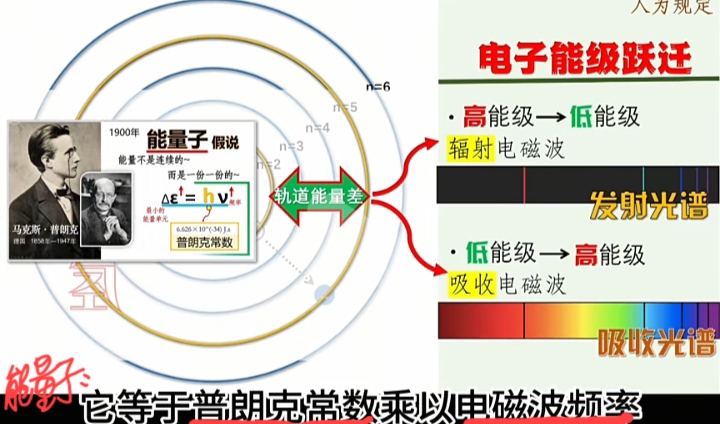
每一种原子的电子轨道是“定态且离散的”,即“激发态”时发射或吸收的“能量子”就是“量子化的能量及其频率”。
太阳光谱的研究
 |
埃(\(\bf{ 10^{10} 数量级 }\)) 源于Angstrom研究太阳光谱过程 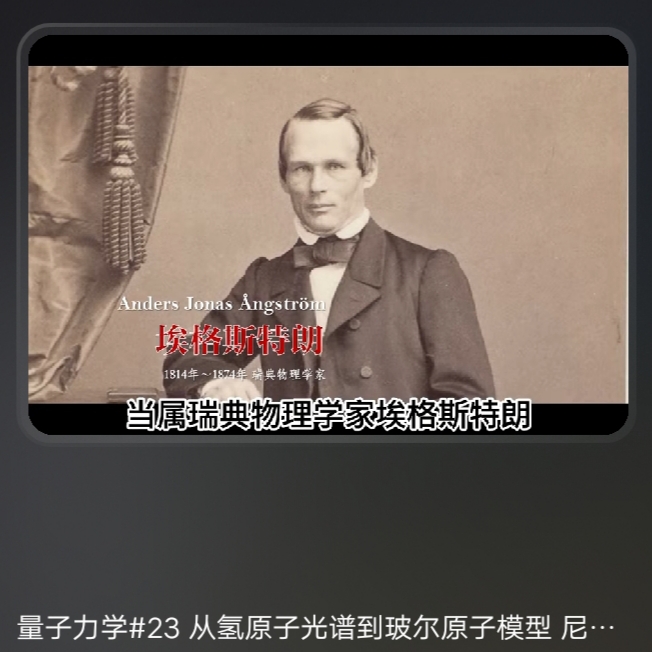 |
|
|---|---|---|



 浙公网安备 33010602011771号
浙公网安备 33010602011771号