应急速“学”包(九年级上—化学Units 1~2)
本速“学”包仅以知识点计。
写在前面的话
你对化学的第一印象是什么?
$A. $好有趣啊,希望学好。
$B. $感觉挺重要的,还是学好一点吧。
$C. $化学学不好可就完了!那么多要背的东西。
相信各位读者早已收到学校发布的文件《初三化学——性价比最高的中考科目》。如果对于上面的问题,你的答案是\(A\),那说明……你没看文件。
以下是我对文件指示的看法,但更多是驳斥。请注意,下面没有任何关于应急速“学”包的推销内容。
关于提前学习
首先很遗憾,我们必须承认,化学是需要提前学的。在九年级的强压力环境下,为了压缩时间不得不提前学。
但是,提前学习讲究某些方法和技巧。如果暑假期间的自学能够掌握所有学校可以学到的知识,那学校的课程又有什么用呢?有的人可能会说是巩固用的,这样岂不就本末倒置了吗?因此,我个人非常不认可“暑假把化学这门学科深挖吃透”的观点。另外,有些同学可能像煮啵一样上了化学补习班,我不反对,如果你能跟上节奏就上吧,无妨;但如果明显感到吃力就算了,这种“伪勤奋”是最没有意义的。
那所谓的“提前学习”指的是什么呢?
在我看来,化学的预习工作只需要做到浏览课本、简要记忆就可以了。当然,这并不代表同学们可以随便翻翻,敷衍式地记忆。原因你也知道,化学的记忆性工作不少,暑假不记,开学可就没脑子记了。
我们分析了近年的化学中考,发现中考开始走回归课本的路线。这一点无需再多证明,各位想必在别的学科也有所体会。因此,在暑假期间熟悉课本,尤为重要。倒不是说需要各位把每一个实验深入分析,就像文章中的重点实验一样。不过至少要做到熟悉课本,大概知道每个实验及其基本流程和原理。这个要求应该不高吧。
接下来就要说说记忆了,那就要引出我觉得那份文件为数不多极佳的地方之一,也就是文件中要背的那部分内容。看到那些堆积如山内容,同学们可能会引发畏难情绪,从而更加讨厌化学。首先需要澄清,化学是一门以实验为基础的科学,实验的快乐远远超过了化学方程式、微粒理论和元素周期律的枯燥乏味,这点在之后也会提及。记忆的内容只是为了更好地理解化学反应的底层原理,并不是故意折磨或者什么的。当然高中例外。
你需要记忆的知识点有:
- 实验仪器及其操作规范。
- 微粒单元的所有理论知识。
- 一些化学方程式。
- 方程式的配平和简要计算方法、格式。
- 九下的诸如酸碱盐、金属活动性顺序等内容。
应该感到庆幸,九上要记忆的内容远比九下少。所以背起来吧,永远记住,你的背后有正在煎熬的煮啵。
化学很有趣!
\(\text {Chemistry=Chem\ is\ try.}\)
这里的\(try\)不仅指的是理论上的猜测和尝试,更多的表示实验。不知道为什么,学校下发的文件读完后,总会让你觉得化学是枯燥的,乏味的,紧张的,全新的,抽象的,没有兴趣的,甚至成为了一种折磨。实则不然。学校的文件只阐述了化学困难的地方,它的趣味性却闭口不谈,虽然我不知道这是为什么,但是这样总归是不妥的。如果让学生对化学的第一印象就是这些,让学生只凭借“化学中考要考”的意志继续学习,那一定是学不远的。
接下来就说一说化学有趣的地方在哪里。顺带对学校文件上的四个特点进行补充。
新学科,接受慢?
文件指出,化学以实验为基础。QZ的化学和物理一样,虽然有自己的实验室,但不多。因此,学生基本不能感受到实验的乐趣,只能通过冰冷的大屏向实验员投以羡慕的眼光。实验很有必要,但我们连课本上的“学生实验”都没做过几个。小学阶段的科学课可能涉及了初中化学的一些知识点,各位可以把它当做初步认知,当然如果被占了就不关我的事咯。
趁着暑假时间充沛,记忆知识点的同时不要忘记捣鼓捣鼓课本实验哦。自己做一做,可能会有不一样的体会。
时间紧,任务重?
别看它说得那么吓人,\(12\)个单元\(158\)个知识点很多吗?隔壁生物学还有\(26\)章\(79\)节呢,每节估计不止四个知识点吧!不还是两年不到的时间就学完了嘛。
化学学习时间确实不充裕,但不能算紧哦。文件上说的只不过是让你暑假多背背的推进策略之一罢了。正常预习即可。
《入门枯燥》
我个人认为,唯一枯燥的也就只有微粒理论和化学方程式(即第三单元和第五单元)了吧!前两单元都是实验探究呢,非常好玩,建议各位好好享受。第三和第五单元嘛,这个理论是之后学习的基础,重要性不必多言,还是认真一点吧。
联系紧,易掉队《成绩每况愈下》
别看它前面新课标的要求讲了一堆,实际上和老教材没有什么变化。知识点关联性强倒是不假,微观粒子的学习有困难也没错。不过这里讲的还是有道理的,不要被困难所打倒!课后多花点功夫记记就可以了,没有什么思维含量。“背多分”的东西,为什么不行动呢?
成绩每况愈下那就更假了。化学第一次月考,大家基本都能维持在\(75\)分及以上(摆人除外)。所以不要担心了!初学化学,困难还在后面!
预祝各位在化学学习方面大展前途,和煮啵一样成功上岸,取得胜利的果实。加油!既然化学是文理双科,那不论你是文科生还是理科生,都可以学好!
绪论
- 人的衣、食、住、行都离不开化学(\(\text {Chemistry}\))。衣:化学纤维和染料;食:化肥与农药;住:建筑材料的化学性质;行:燃料。

- 人类认识化学并使之成为一门独立的学科,经历了漫长的探索过程。


- 认识一些科学家及其成就:
- 拉瓦锡:质量守恒定律、研究水和氧气。(九上化学,我包了!)
- 门捷列夫:发现元素周期律,排元素周期表。
- 道尔顿:提出原子论。
- 阿伏伽德罗:提出分子论。
- 现在,人们对物质的研究从宏观深入微观,达到了原子和分子水平。

- 我国在化学基础研究领域取得长足发展。

- 化学是研究物质的组成、结构、性质、转化及应用的一门基础学科,其特征是从分子层次认识物质,通过化学变化创造物质。

第一单元—走进化学世界
课题\(1\):物质的变化和性质
【知识点】化学变化和物理变化
【实验】水的沸腾;
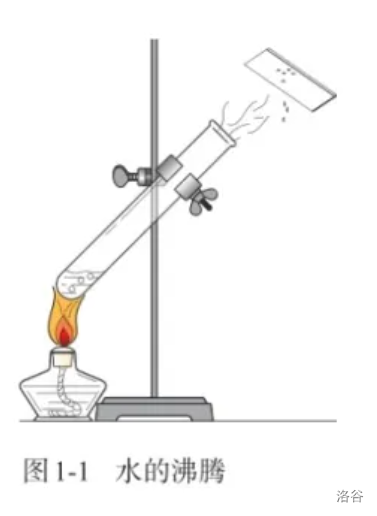
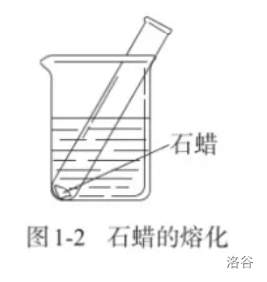
【实验】石蜡的熔化;
【实验】氢氧化钠溶液与硫酸铜溶液反应;
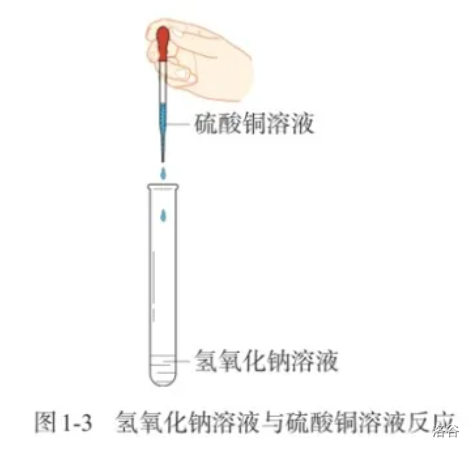
剧透:复分解反应,化学方程式为
\[2NaOH + CuSO_4 = Cu(OH)_2↓ + Na_2SO_4 \]
【实验】大理石与稀盐酸反应。
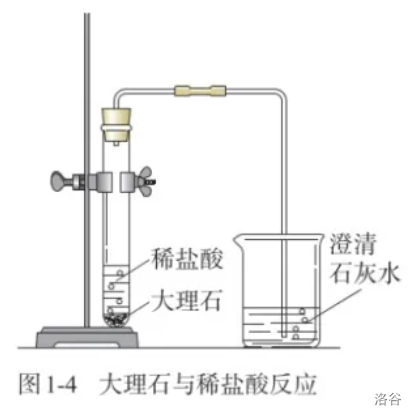
剧透:复分解反应,化学方程式为
\[CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2↑ \]
- 在前两个实验中,水和石蜡发生了形态上的变化,但没有生成新的物质;而后两个实验中,都有新的物质产生(蓝色沉淀和使澄清石灰水变浑浊的气体,即氢氧化铜和二氧化碳)。
- 没有生成新物质的变化叫作物理变化;生成新物质的变化叫作化学变化,又叫化学反应(\(\text {chemical\ reaction}\))。
举例:一切单独的物态变化和形态变化都是物理变化;燃烧、生锈、发酵(以上都属于氧化)是化学变化。 - 化学变化的最本质特征:有新物质生成。常见表现:变色、产生气体、生成沉淀。常常伴随能量变化,表现为吸放热和发光等。

- 物质发生化学变化的同时,一定会发生物理变化。反之则不成立。
【知识点】化学性质和物理性质
【活动】观察一瓶酒精,你认为它有什么性质?
密度小于水;易溶于水和其他液体;有刺激性气味;无色透明;易挥发性;可燃性;助燃性……
- 我们将物质在化学变化中表现出来的性质称为化学性质(\(\text {chemical property}\))。物质不需要发生化学变化就表现出来的性质叫作物理性质。
举例:易生锈,易氧化,可燃性,(在化学反应下)发光发热,可与其他物质产生化学反应等都是化学性质;物质的颜色、气味、硬度、熔点、沸点、密度等(在物理课上学过的物质属性)都是物理性质。 - 需要通过化学反应验证的物质性质,都是化学性质。反之,一定是物理性质。例如,酒精具有可燃性,想要验证,必须亲自烧一下酒精;燃烧属于化学反应,因此可燃性属于化学性质。
【技能点】分辨物质的性质、变化和用途
- 用途。陈述一般带“可用作”“可作为”“可用于”字样。容易区分。
- 性质。陈述一般带“可”“能”“易”“不易”“难”等表示能力或属性的字样。至于如何区分物理性质和化学性质,参见上文。
- 变化。陈述一般带“燃烧”“反应”“分解”等表示变化的词语(容易发现),并且前面不加表示能力或属性的词。至于如何区分物理变化和化学变化,参见上文。
课题\(2\):化学实验与科学探究
早期人类化学实验珍贵影像
(秦始皇当年为什么要吃仙丹呢?明明就是氧化汞啊。)
(Tips:汞有剧毒。)
观前提示:本课题知识点排布顺序和新版化学书不同。
【引言】认识基本的实验仪器
初学时,仪器的用途可以查表,但是名称和图要一一对应。
| 名称 | 简图 | 主要用途 |
|---|---|---|
| 烧杯 | 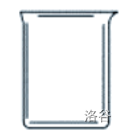 |
配制溶液;较大量试剂的反应容器;可加热 |
| 试管 |  |
少量试剂的反应容器;可加热 |
| 蒸发皿 | 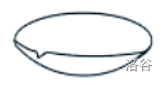 |
蒸发液体;浓缩结晶;可加热 |
| 锥形瓶 | 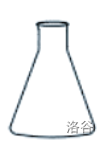 |
用于中和滴定;装配气体发生器;蒸馏液体的接受器;可加热 |
| 量筒 |  |
量度液体体积;不可加热;不可反应 |
| 集气瓶 | 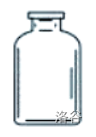 |
手机或贮存少量气体;不可加热 |
| 漏斗 | 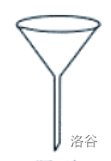 |
过滤;向小口容器内注入液体 |
| 分液漏斗 | 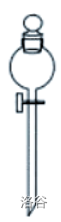 |
分离不相溶的液体;装配气体发生器,不断向烧瓶中添加液体试剂 |
| 长颈漏斗 | 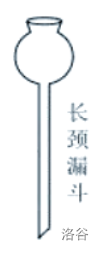 |
加液;气体发生器 |
| 陶土网(旧:石棉网) |  |
使仪器受热均匀(石棉网易自燃,因此新教材中改用陶土网) |
| 试管夹 |  |
夹持试管 |
| 铁架台 |  |
固定支持各种仪器,一般用于过滤或加热等 |
| 酒精灯 | 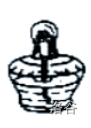 |
加热 |
| 胶头滴管(配滴瓶) |  |
吸取和滴加少量液体 |
| 水槽 |  |
排水集气 |
| 研钵 |  |
研磨固体物质 |
| 药匙 |  |
取粉状或小颗粒固体试剂 |
| 燃烧匙 |  |
做少量药品的燃烧实验 |
| 坩埚钳 |  |
夹取热的坩埚、蒸发皿等;夹金属丝(条)做燃烧实验 |
| 玻璃棒 |  |
搅拌、过滤或转移液体 |
| 试管架 |  |
放置试管 |
| 试管刷 |  |
洗刷各种仪器、器皿 |
| 广口瓶和细口瓶 |  |
分别存放固体药品和液体药品;不可加热 |
【知识点】【技能点】学会基本实验操作
以下操作按照实验顺序排序。
连接仪器
- 把玻璃管插入带孔橡皮塞:先把要插入塞子的玻璃管一端用水润湿,然后稍稍用力转动将其插入。
- 连接玻璃管和乳胶管(胶皮管):先把玻璃管口用水润湿,然后稍稍用力即可把玻璃管插入乳胶管。
- 在容器口塞橡皮塞:应把橡皮塞慢慢转动塞入容器口。切不可把容器放在桌上再使劲塞进塞子,以免压破容器。
- 需要用力的事情都用右手来做。
用水润湿的作用是使其更容易插入;
必考点:放在桌上塞橡胶塞的直接打叉。
检查装置气密性(★★★)
先检查气密性!再装药品做实验!
- 先将右侧导管末端口浸在盛有水的烧杯/水槽内,两手紧握试管外壁加热,导管口若有气泡逸出,且松手后有一段稳定的液柱形成,则说明装置气密性良好。
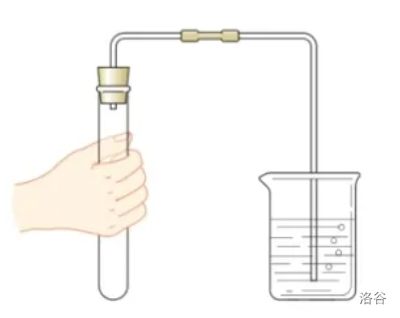
化学是一门十分注重表达的科学,这是毋庸置疑的。在上面的文字中,如果我把“盛有水的”去掉,似乎也符合常理,但在考试中一分不得。
化学没有常理之说。
- 通用做法:把需要检查气密性的一段装置的开口(如上图中的导管口)浸没在水中,然后在一段封闭的装置(如上图中的试管)用双手或酒精灯加热。检验方法同上。
- 原理:气体受热膨胀,气压变大,将管内液面顶到管口,继续溢出导管后就会形成气泡浮出水面。松手后,气体遇冷收缩,气压变小,管外气体就会把液柱顶入管内。
取用药品
实验室内的所有实验试剂都是药品。甚至我们收集的空气、蒸馏水也是药品。定义很奇怪,不是吗?
注:现新版化学书均改为“试剂”。本文两词并用。
-
存储:固体药品通常存在广口瓶中,液体药品通常存在细口瓶中,气体药品存在集气瓶中,特定药品存在专用的药瓶中。集气瓶表面做了磨砂处理;广口瓶和细口瓶口内侧做了磨砂处理,用于配合磨砂玻璃塞或橡胶塞实现密封。集气瓶通常盖玻璃片,玻璃片一面磨砂一面光滑,磨砂面应朝向集气瓶口。

-
取用原则:
- 安全原则:不尝(高锰酸钾很像元气森林葡萄汁哦!要喝一口吗),不触(浓硫酸是粘稠的哦,要感受一下吗),不直接闻(氨水的味道很独特哦)。
- 经济原则:指明了药品用量,则严格按照规定取用;若未指明,一般液体取\(1-2mL\),固体盖满试管底部即可。
- 剩余原则:用剩的药品不放回原瓶(污染了药品你赔得起),也不要随意丢弃(准备往厕所下水道里丢氨水祸害隔壁吗),更不要拿出实验室(你妈以为你带了一瓶葡萄汁回来,咕咚咕咚喝掉了)。要放入指定容器中。
-
固体药品通用取法:
- 粉末固体、小颗粒药品:用药匙或纸槽,做到一横(将试管横放),二伸(将药匙或纸槽伸入试管),三慢竖(慢慢竖立起来)。
注意:尽量伸入试管底部,避免药品残留在容器壁或容器口。
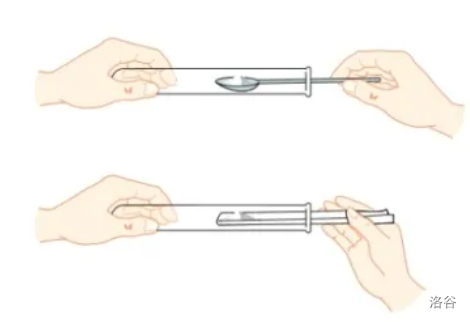
- 块状或较大的金属颗粒:用镊子夹取,做到一横(将试管横放),二放(放入容器口),三竖滑(将容器慢慢竖立起来,使块状试剂缓缓地滑到容器底部)。
注意:此处是放入容器口,然后让试剂缓缓滑到容器底部。注意不要打破容器。
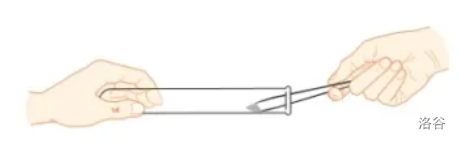
- 粉末固体、小颗粒药品:用药匙或纸槽,做到一横(将试管横放),二伸(将药匙或纸槽伸入试管),三慢竖(慢慢竖立起来)。
-
液体药品通用取法:
一般使用倾倒法。【思考与讨论】观察下面的液体倾倒规范图,思考如下问题:
- 瓶塞为什么要倒放?
- 标签为什么朝向手心?
- 瓶口为什么紧挨着试管口?
- 应该快速倾倒,还是缓慢倾倒?
- 倒完液体后,应该立即做什么?
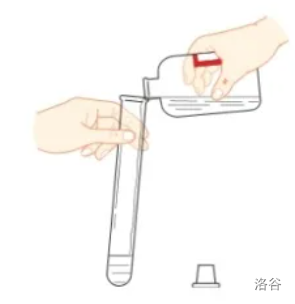
- 瓶塞要倒放在桌面上,以避免塞子沾染桌上的杂质而污染试剂。
- 标签要朝向手心,以防止瓶口残留的药液流下污染、腐蚀标签。
- 瓶口要紧挨着试管口,以防止液体洒落或流到试管外。
- 应该缓慢倾倒,理由同第三点。
- 倒完液体后,应立即盖紧瓶塞,并把试剂瓶放回原处,以防止试剂挥发、改变性质或交叉污染。
-
定量液体取法:
一般使用量筒量出体积。- 凹液面和凸液面
当液体置于窄口容器中时,液面可能会出现以下两种情况:
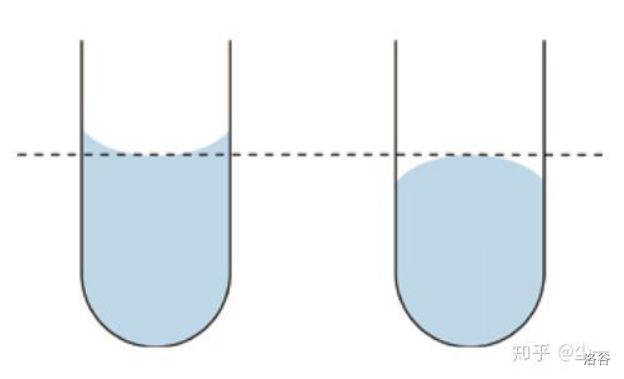
左边的液面顾名思义,称为凹液面,水(\(H_2O\))在窄口容器中会形成凹液面;右边的是凸液面,液态汞(液态水银,\(Ag\))就会形成凸液面。 - 读数要求
与物理中一样,读数时量筒需放平,视线与量筒内液体凹液面的最低处保持水平(如上图)。仰视读数则偏小,俯视读数则偏大。
另外需要注意的是,如果需要量取定量的液体,仰视读数则偏多,俯视读数则偏少。可以参考煮啵做的粗糙示意图。
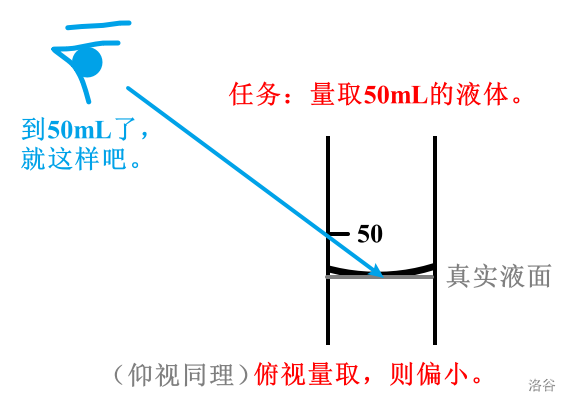
例题:一学生从量筒中倒出液体时,俯视读数读出\(80mL\);倒完液体后,仰视读数读出\(60mL\)。求该学生倒出的液体体积的取值范围。
解:由题意得:
\[V_0<80mL, V_1>60mL \]\[\therefore \Delta V=V_0-V_1<20mL \]故倒出的液体体积小于\(20mL\)。
- 凹液面和凸液面
-
少量液体取法:
一般使用胶头滴管。- 使用方法:先按下胶帽以排出管内空气,然后保持按下的同时将管口浸入液体内。松开胶帽,移动至容器口后再按下胶帽,即可将液体排出。
- 使用原理:大气压。
- 不得在管口浸入液体后,再按下胶帽排出空气,以避免出现气泡或污染试剂。(做题时,可以观察液体内是否有气泡冒出来判断。)
- 滴管取液后,应保持胶帽朝上,防止液体倒流沾污试剂或腐蚀胶帽。(你也不希望小红帽被浓硫酸烧穿,然后滴到你的手上吧?)
- 不得把胶头滴管放在实验台上,以免沾污滴管。
- 胶头滴管用完后要立刻洗净,然后再取液体。但是,滴瓶上配的专用滴管不可清洗。
加热
加热是实验中最常见的反应条件和基本操作。
-
需要使用:酒精灯。
注意事项:- 酒精灯内酒精体积占\(\frac 1 4\)到\(\frac 2 3\)最佳。
- 绝对禁止向燃着的酒精灯里添加酒精。
- 绝对禁止用酒精灯引燃另一只酒精灯(“借火”)。
- 用完酒精灯后,
不可用嘴吹灭(不知道能不能用手捏灭),必须用灯帽盖灭,盖灭后轻提一下灯帽,再重新盖好。(为什么?) - 如不慎碰倒酒精灯,不要惊慌,万一洒出的酒精在实验台上燃烧起来,应立即
用水灭火用湿抹布扑盖。
(原因:盖上灯帽后,酒精灯还会再燃烧一段时间消耗氧气,导致内部气压减小。如果不提,长时间后再用的话,由于大气压的存在就打不开了。)

加热时,要用酒精灯的外焰。
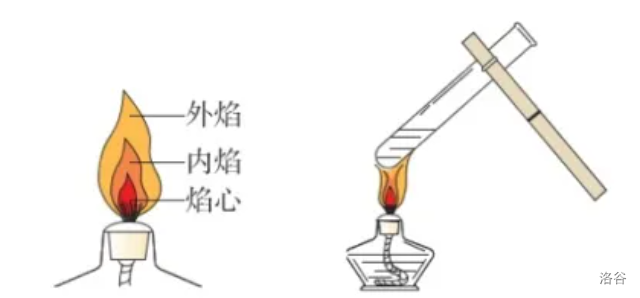
-
物质加热通用方法:
- 试管中液体体积不超过试管的\(\frac 1 3\)。(特别容易忽略!)
- 用试管夹夹持试管时,应从试管底部套上取下。
- 加热时,先使试管底部均匀受热,然后对准药品集中加热。
- 加热固体药品时,试管略向下倾斜(目的:防止冷凝水回流到热试管底部使试管炸裂,考试不写“热”一分不给);加热液体药品时,试管略向上倾斜,与水平面夹角小于\(45\degree\)(你向下斜一个试试)。
- 加热后的试管不能立即接触冷水或用冷水冲洗。
- 加热烧杯记得用陶土网垫上,使用铁架台固定。先调酒精灯正上方的铁架以适应酒精灯的高度(物理的熔化实验要点)。
洗涤玻璃仪器

当玻璃上附着的水既不聚成水滴,也不成股流下时,表明仪器已洗干净。
【实验】探究蜡烛及其燃烧
蜡烛主要由石蜡和棉芯组成。为探究蜡烛在燃烧前、燃烧时和燃烧后的性质,你可以遵循以下实验步骤:
(备注:以下的斜体为现象,粗体为结论或推断。)
-
观察:蜡烛在正常环境下是固态竿状物,普通蜡烛呈白色且无明显气味。(物理性质)
-
操作:切下一小块蜡烛,放入水中,石蜡漂浮。可以得出,石蜡密度比水小,且难溶于水。
-
操作:点燃蜡烛,观察发现以下几点。
-
火焰附近,石蜡熔化成液态(得出石蜡熔点较低)。
-
拓展实验:将蜡烛竖直放置,需要很久才能滴下液态石蜡;但横放则能很快滴下。这是为什么?
理由:竖直放置时,顶端的石蜡熔化后接着汽化成为石蜡蒸汽,进而被火焰点燃。液态石蜡也可被火焰引燃,这二者(其实都是石蜡)成为蜡烛持续燃烧的条件(也就是之后要学习的可燃物)。横放时,液态石蜡来不及加热到沸点就滴了下来。由此可以得出,石蜡的沸点也不高。 -
烛芯变黑。这是燃烧导致棉芯被加热的结果。
-
火焰分\(3\)层。即:焰心、内焰和外焰。
- 焰心位于火焰中心,呈深蓝色、暗色或干脆透明。燃烧不完全,温度最低,约\(600-800\degree C\)。液态石蜡在此处汽化。(存在还原性。煮啵曾尝试捏灭蜡烛火焰,大获成功,其技巧就是对着焰心捏。)
- 内焰呈深红或浅黄色,燃烧较充分,温度约\(800-1000\degree C\)。石蜡蒸汽在此部分燃烧。
- 外焰通常无色或呈淡蓝色,与空气充分接触,燃烧也最为充分,温度可达\(1200-1400\degree C\)。(具有氧化性。)
【思考】蜡烛燃烧,石蜡慢慢变少,消失的那部分石蜡变成什么了呢?还是就此凭空消失?
-
猜想:石蜡燃烧生成了水蒸气。
实验:取一个干燥的烧杯罩在火焰上方。
现象:烧杯内生成了水雾。
结论:石蜡燃烧生成了水蒸气。【知识点】检验水蒸气的方法:用干冷的烧杯罩在气体上方,若生成水雾,则气体是水蒸气。
-
猜想:石蜡燃烧生成了二氧化碳。
实验:取一个用澄清石灰水润湿内壁的烧杯罩在火焰上方。
现象:澄清石灰水变浑浊。
结论:石蜡燃烧生成了二氧化碳。【知识点】检验二氧化碳的方法:若气体能使澄清石灰水变浑浊,则该气体是二氧化碳。
原理如下:\[CO_2+Ca(OH)_2=CaCO_3↓+H_2O \]其中浑浊物质是白色的碳酸钙(\(CaCO_3\))沉淀。

-
-
操作:熄灭蜡烛后,发现蜡烛产生了白烟。
【思考】白烟是什么?
- 猜想:白烟是水蒸气。
实验:取一个干燥的烧杯罩在火焰上方。
现象:烧杯内没有生成水雾。
结论:白烟不是水蒸气。 - 猜想:白烟是二氧化碳。
实验:取一个用澄清石灰水润湿内壁的烧杯罩在白烟上方。
【辩证】这样操作可以得到正确的结论吗?并请说明理由。
【解答】不能,因为蜡烛燃烧也产生二氧化碳,会干扰实验结果。 - 猜想:白烟是石蜡固体小颗粒。(对得出这个猜想的人注意力致以崇高的敬意。)
实验:用燃着的火柴去点白烟。
现象:蜡烛复燃。
结论:白烟是石蜡固体小颗粒。
【辩证】该实验不仅证明了白烟中含有石蜡固体小颗粒,还说明了什么?
【解答】还否定了上一个猜想,因为\(二氧化碳不可燃,通常情况下也不助燃(不支持燃烧)\)。
- 猜想:白烟是水蒸气。
-
我们在化学的实验探究中,一定要关注物质的性质、变化及其变化的过程,并对结果加以合理的讨论和解释。探究结束后,可以完成实验报告。
第二单元—空气和氧气
课题\(1\):我们周围的空气
【实验】拉瓦锡研究空气成分实验
实验详情:
- 把少量汞(水银,\(Ag\))放入密闭的容器中连续加热\(12\)天,发现有一部分银白色的液态汞变成红色粉末,同时容器里空气的体积减少了。(通过汞槽里水位的上升可以看出,简易气压计原理。)
- 拉瓦锡研究了剩余的这部分气体,发现它们既不能供给呼吸,也不能维持燃烧。他把这些气体命名为氮气(\(N_2\)),拉丁文\(nitrogenium\)原意是“不能维持生命”。
- 他把红色粉末收集起来,放在另一个容器里再加强热,又得到了汞和氧气(\(O_2\)),而且氧气的体积恰好等于密闭容器里所减小的体积。把氧气加到之前大容器里的剩下的气体里后,所得气体性质和空气完全一样。再根据汞槽上升的情况,他得出了以下结论:\[空气由氧气(O_2)和氮气(N_2)组成,其中氧气约占总体积的\frac 1 5。 \]
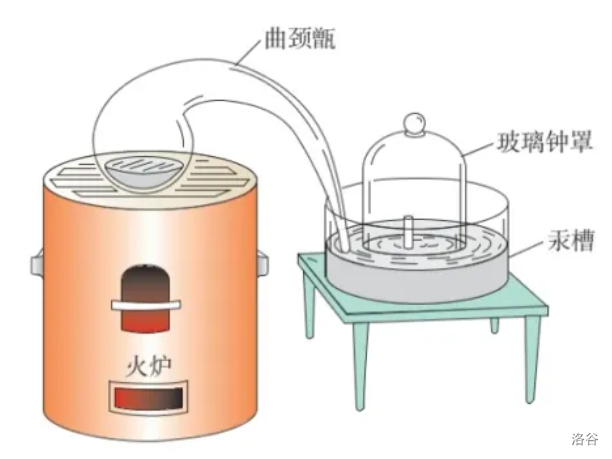
实验原理:
笔者注:在学习化学方程式一章之前,我们描述化学变化时都写符号表达式。不要写化学方程式!不要配平!不要配平!你会配吗你?你会验平吗?配错了一分没有!不要装\(13\)!,老老实实画箭头!配对了,也不一定给分,说不定题目就要求写符号表达式,你这不是搬起石头砸自己的脚吗?
汞(\(Hg\))和氧气(\(O_2\))加热生成氧化汞(\(HgO\),红色粉末):
笔者注:在符号表达式和化学方程式中,条件加热也可用一个三角形表示,即\(\triangle\)。上述的符号表达式也可写成:
\[Hg+O_2\stackrel{\triangle}{\longrightarrow}HgO \]
文字表达式:
氧化汞加热生成汞和氧气:
文字表达式:
实验基本注意事项(后可能有更新!):
- 实验中使用试剂汞的作用都是为了消耗空气中的氧气吗?
显然不是。仔细观察实验图:

不难发现,汞槽内的汞是为了显示氧气消耗的体积,曲颈甑(\(\text {zèng}\))里的汞才是为了消耗氧气的。
至于为什么不是水槽,可能是当时拉瓦锡感觉空气中氧气含量应该不少,根据托里拆利实验不难发现,用水的话,高度差甚至可达到汞的十倍。照这个样子,玻璃钟罩都得被压碎了。 - 为什么要用汞?
很简单,换个木炭的例子你就懂了。木炭和氧气加热生成二氧化碳:\[C+O_2\stackrel{\triangle}{\longrightarrow}CO_2 \]如果换成木炭,生成的二氧化碳又会补进一部分气体,那还能准确测出氧气含量吗?显然不能,会导致测量结果不准。
氧化汞是固态红色粉末,天生适配拉瓦锡的实验。 - 加热结束后就可以直接测量汞柱上升长度了吗?
需要等待冷却到室温。理由很明显呢,气体受热膨胀,气压高于实际值,会导致测量结果偏小。
空气的成分
\(20\)世纪以来,人们又发现了氦、氖、氩、氪、氙、氡等稀有气体,才发现拉瓦锡当年的结论差了一点。根据现在的精确实验测定,空气中的气体含量,按体积分数记,含有:
| 氮气(\(N_2\)) | 氧气(\(O_2\)) | 稀有气体\(^*\)(元素周期表最后一列) | 二氧化碳(\(CO_2\)) | 其它气体和杂质 |
|---|---|---|---|---|
| \(78\%\) | \(21\%\) | \(0.94\%\) | \(0.03\%\) | \(0.03\%\) |
\(*\)稀有气体又称惰性气体,因为它们的化学性质很不活泼。
注意!一定是体积分数(即按体积总量计算百分比)!生物学死去的回忆坑了我好多次。
【学生实验】红磷燃烧测氧气含量
由于汞有剧毒,学生实验中一般改用红磷作为反应物探究。
实验步骤:
知识拓展:磷,符号\(P\),由磷原子构成。有红磷和白磷之分,二者化学性质基本相似。
重要区别:白磷有剧毒!!!
- 连接好仪器,并检查装置气密性(漏气会怎么样\(^①\))。这种装置的气密性检查方法之前已经详细说过,这里不再赘述。
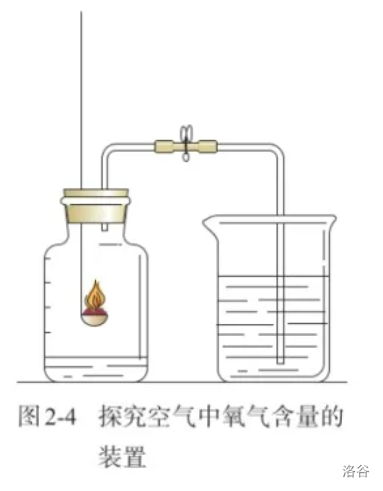
- 在集气瓶内装入少量水(为什么\(^②\)),并把水面上方的空间分为五等分(意图很明显)。弹簧夹夹紧乳胶管(不夹紧会怎么样\(^③\))。
- 在燃烧匙内加入足量的红磷(不足量会怎么样\(^④\)),用酒精加热引燃红磷后,迅速伸入瓶中(不迅速会怎么样\(^⑤\)),并塞紧橡胶塞。
- 待红磷熄灭并冷却至室温(不冷却到室温会怎么样\(^⑥\)),打开弹簧夹。
实验原理:
文字表达式:
实验现象:
烧杯中的水被吸入集气瓶,瓶内液面上升,到达最下方的等分刻度线时停止。
实验结论:
空气中的氧气体积占总体积的\(\frac 1 5\)。
误差分析:
- 如果测出氧气体积分数小于\(\frac 1 5\),则可能是因为:
- 装置漏气,内部气体得到补充,气压偏大。(\(①\))
- 未冷却至室温就打开弹簧夹,内部气体膨胀,气压偏大。(\(⑥\))
- 红磷量不足,氧气未耗完,内部气压偏高。(\(④\))
- 结果偏大,则可能是由于:
- 燃烧匙伸入过慢,瓶口附近气体加热,使部分瓶内空气逸散。后续过程全部在密封环境内进行,最终瓶内空气必然偏少,致使认为氧气含量偏大。(\(⑤\))
- 弹簧夹未夹紧,受热气体部分逸出,最终结果同上。(\(③\))
实验基本注意事项(后可能有更新!):
- 在集气瓶中装入少量水的目的是加速冷却、防止瓶内气压骤增导致橡胶塞被冲开,并吸收有毒的五氧化二磷。
- 该实验不能测量空气中除氧气以外其它气体的含量。
【科学·技术·社会】勾石数字化实验装置:

混合物与纯净物
- 由两种及以上的物质混合而构成的物质是混合物(\(\text {mixture}\))。混合物中的各物质保持自己的性质。如洁净的空气,再洁净也是由多种气体混合而成的,始终是混合物。氯化钠(\(NaCl\))虽然由氯离子(\(Cl^-\))和钠离子(\(Na^+\))构成,但氯化钠不再保持氯和钠的性质,因此氯化钠作为一种新物质,是纯净物。(毕竟你也不想吃一口盐等价于加一口钠吧。)
- 只由一种物质构成的物质是纯净物(\(\text {pure\ substance}\))。纯净物可以用单个化学式表示,如液氧(\(O_2\))、五氧化二磷(\(P_2O_5\))等。
空气成分及其作用
| 气体类型 | 性质 | 用途 |
|---|---|---|
| 氧气(\(O_2\)) | 无色无味;密度大于空气;不易溶于水;化学性质比较活泼,支持燃烧 | 燃烧、呼吸、医疗急救、炼钢、气焊、航空航天等 |
| 氮气(\(N_2\)) | 无色无味;密度略小于空气;难溶于水;化学性质不活泼,不支持燃烧 | 作保护气(防腐)、液氮冷冻治疗、显示超导性能\(^*\) |
| 稀有气体 | 无色无味;化学性质很不活泼;通电时能发出不同颜色的光(这是物理性质) | 霓虹灯、闪光灯、航标照明灯等\(^{\#}\) |
| 二氧化碳(\(CO_2\)) | 敬请期待… | 敬请期待… |
请注意“不易”和“难”的区别,考试绝对会抠字眼!
\(*\)超导体是指在某一温度以下,兼具绝对零电阻和完全抗磁性两个独立特性的超级导体。简单来说,就是这些超导体的电阻绝对为零,电流在传输过程中没有任何损耗,是不多见的理想材料之一。超导体对温度限制很严格,液氮的沸点是\(-196\degree C\),也才能刚刚满足某些超导材料的临界温度。在临界温度以下,超导体可以悬浮在其它导体之上,并具有绝对零电阻。
\(\#\)一般来说,汽车大灯中充入了氙气(\(Xe\)),使其发出的光具有穿透力和强度;氢气(\(H_2\))的密度比空气低,因而氢气球一松手就会飘到天空上。但是氢气易爆,因此一般在气球中充入氩气(\(Ar\)),同样能达到效果。
知识拓展:判别气体的密度
空气的平均相对分子质量是\(29\),因而气体密度的判别可以看它的相对分子质量(着啥急,后面讲)。如果其相对分子质量小于\(29\),则说明密度比空气小;反之密度比空气大。
氮气的相对分子质量为\(28\),略小于\(29\),因此密度略小于空气。
保护大气环境
这里用知识点的方式简单带过一下。
- 属于空气污染物的有:可吸入颗粒物(\(PM_{10}\));细颗粒物(\(PM_{2.5}\));二氧化硫(\(SO_2\));一氧化碳(\(CO\));二氧化氮(\(NO_2\));臭氧(\(O_3\))等。
注意:- 如果有些题目中提到“氮的氧化物”(\(NO_x\)),也算对。
- 二氧化碳不算空气污染物!二氧化碳不算空气污染物!!二氧化碳不算空气污染物!!!
- 了解空气质量指数(\(\text {air quality index, AQI}\))和空气质量评级。质量指数越高,说明空气污染越严重。
- 保护大气环境的几种措施,这里就不说了,就看各位生物课有没有好好听课了。
课题\(2\):氧气(\(\text {oxygen}, O_2\))
氧气的物理性质
- 密度比空气大。
- 不易溶于水。在室温下,\(1L\)水能溶解约\(30mL\)氧气。
- 在标准状况下\(^*\),氧气的沸点是\(-183\degree C\),熔点是\(-218.8\degree C\)。液氧和固态氧气都是淡蓝色。
氧气的化学性质
【实验】氧气的可燃性
| 步骤 | 现象 | 结论 |
|---|---|---|
| 将带火星的木条插入装满氧气的集气瓶内 | 木条复燃 | 氧气支持燃烧 |
由此推出:
| 步骤 | 现象 | 结论 |
|---|---|---|
| 将带火星的木条插入集气瓶内 | 木条复燃 | 集气瓶内盛有氧气 |
【实验】碳在氧气中燃烧
步骤说明:用坩埚钳夹取一块木炭,在空气中点燃,观察现象;点燃后伸入盛有氧气的集气瓶内,观察现象。

| 现象 | |
|---|---|
| 碳在空气中燃烧 | 持续红热,生成一种能使澄清石灰水变浑浊的气体 |
| 碳在氧气中燃烧 | 剧烈燃烧,发出白光,放出大量热,生成一种能使澄清石灰水变浑浊的气体 |
注:有的同学可能有疑问,说为什么不能直接写“二氧化碳”,非要说“能使澄清石灰水变浑浊的气体”呢?
因为这里填的是现象,是你能通过感官直接感受到的。你能看出来碳燃烧生成的就是二氧化碳吗?当然不行。所以你需要一个能证明它是二氧化碳的现象,即澄清石灰水变浑浊了。
实验表明,碳在氧气中燃烧,生成二氧化碳(\(CO_2\))等气体,并放出大量热。
注:这里说“等”是因为碳还可能和氧不充分燃烧生成一氧化碳(\(CO\)),在第六单元将会学到。
【实验】硫在氧气中燃烧
步骤说明:在燃烧匙中放入少量硫,在空气中点燃,观察现象。点燃后伸入盛有氧气的集气瓶中,观察现象。

| 现象 | |
|---|---|
| 硫在空气中燃烧 | 出现淡蓝色火焰,放热不明显 |
| 硫在氧气中燃烧 | 剧烈燃烧,发出明亮的蓝紫色火焰,放热,生成一种有刺激性气味的气体 |
实验表明,硫在氧气中燃烧,生成一种有刺激性气味的二氧化硫(\(SO_2\))气体,并放热。
注:该实验需在通风橱中完成。主要是因为二氧化硫太难闻了(手动狗头)。如果各位不信,可以从自家的硫磺皂上研磨下来一些粉末,就是硫单质。在空气里点燃,烧一段时间后你就会明白了。
【实验】铁在氧气中燃烧
步骤说明:把两根光亮的细铁丝弯成螺旋状。取一根在酒精灯上烧成红热,观察现象。另一根在下端系上火柴,点燃火柴, 待火柴快燃尽时, 伸入盛有氧气的集气瓶中(瓶内预先放一些水),观察现象。【煮啵自己拍的视频】

本实验需要注意:
- 光亮:防止表面的铁锈或铁的氧化物阻止反应。
- 螺旋状:增大铁丝与氧气的接触面积,使反应更充分。
- 在下端系上火柴:引燃铁丝用的。
- 待火柴快燃尽时:刚视频里应该也讲了,火柴燃烧也会消耗氧气,可能使得铁丝的反应不明显。
- 瓶内预先放一些水:防止高温熔融物溅落,使集气瓶炸裂。同时起到冷却的作用。
| 现象 | |
|---|---|
| 铁在空气中燃烧 | 红热,但不燃烧 |
| 铁在氧气中燃烧 | 剧烈燃烧,火星四射,放出大量热,生成黑色固体 |
实验表明,铁在氧气中燃烧,生成黑色的四氧化三铁(\(Fe_3O_4\))固体,并放热。
【拓展实验】镁在氧气中燃烧;铜在氧气中燃烧
- 氧气的化学性质比较活泼。
- 可燃物在氧气中燃烧比在空气中燃烧更剧烈。
- 某些物质在空气中无法燃烧,但在氧气中可燃。
- 物质在空气中燃烧,实际上是在与其中的氧气发生反应。
因为空气中氧气含量较低,所以可燃物在空气中燃烧不如在氧气中剧烈。
化合反应和氧化反应
- 由两种或两种以上的物质生成另一种物质的反应称为化合反应(\(\text {combination reaction}\))。它是化学四大基本反应类型之一。
- 物质与氧气发生的反应属于氧化反应(\(\text {oxidation reaction}\))。它不是化学四大基本反应类型之一。
- 剧烈氧化会放热、发光,如物质在氧气中燃烧。
- 缓慢氧化则进行得很慢,甚至不容易被察觉,如发酵、呼吸、腐烂等。
课题\(3\):制取氧气
在很长的一段初学时间里,本课题将会作为最最最最最最重点的实验课题,在各类大考小考中压轴出场。
工业制氧—分离空气法
工业上,人们通过降低温度和加压的方法,使空气液化。然后升温。由于液氮的沸点比液氧低,从而更早地汽化,剩下的液体就主要是氧气了。把氧气加压后密封在钢瓶中,可以节省很大一部分体积。
固固加热型和固液常温型反应装置
观察以下两个装置,猜测它们分别适用于怎样的反应?
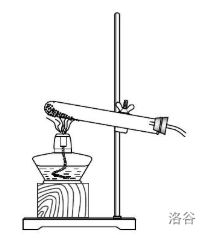
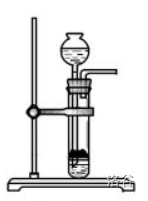
第一种装置适用于仅固体参与反应、且需要加热的反应类型,称为固固加热型反应装置;第二种装置(试管可换为烧瓶;长颈漏斗可换为分液漏斗、注射器,也可直接去除)适用于固体和液体在常温环境下参与反应,称为固液常温型反应装置。二者各有适用场合。
三种固液常温型装置的好处
- 试管(烧瓶)+单孔橡胶塞+导管:装置简单,节省药品。
- 长颈漏斗+试管(烧瓶)+双孔橡胶塞+导管(图):便于添加液体药品。
注意:为了保证反应气体不通过长颈漏斗逸出,需要将长颈漏斗伸入管内液面下方,形成液封。 - 分液漏斗(注射器)+试管(烧瓶)+双孔橡胶塞+导管:便于控制液体药品滴加速率,控制反应速率。
以后还会学习更多类型的反应装置,但这是两种最基本的装置,务必掌握。
收集气体的方法
通常来说,收集气体有三种方法:排水法、排空气法和万能收集瓶法。下面分别讲述三种方法。
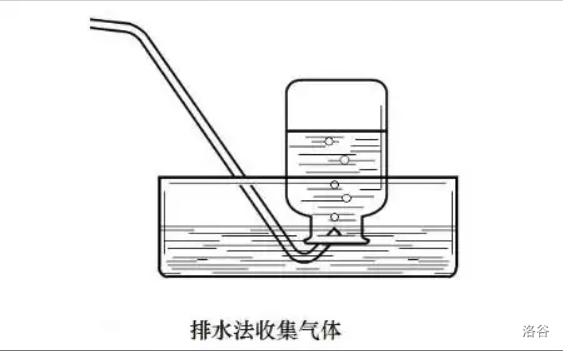
排水法
- 条件:所收集的气体不易(难)溶于水,且不与水中任何成分发生化学反应。
- 操作:如图,将导管放在瓶下方,气体会自发上浮并排走集气瓶内的水。若水面出现大气泡连续均匀冒出,则说明气体集满。集满后,不要着急,先用玻璃片盖住集气瓶口,再将瓶拿出水面。(目的:防止气体扩散到空气中。)
- 气体性质:纯净但潮湿。
排空气法
- 向下排空气法
- 条件:气体密度比空气小,且不与空气中任何成分发生化学反应。
- 操作:如图,将导管伸入集气瓶内,气体就会自发飘在集气瓶顶端,并渐渐把瓶内空气排出。若要验满,需要根据收集气体的性质做出不同操作。集满后,立即盖上玻璃片。
- 气体性质:不太纯净但干燥。
- 向上排空气法
- 条件:气体密度比空气大,且不与空气中任何成分发生化学反应。
- 操作:如图,将导管伸入集气瓶内,气体就会自发沉在集气瓶底部,并渐渐把瓶内空气排出。若要验满,需要根据收集气体的性质做出不同操作。集满后,立即盖上玻璃片。
- 气体性质:不太纯净但干燥。
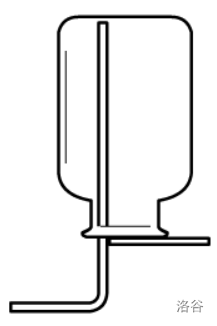
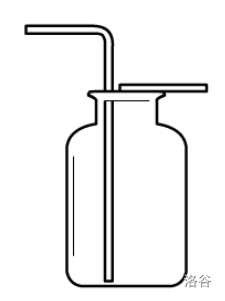
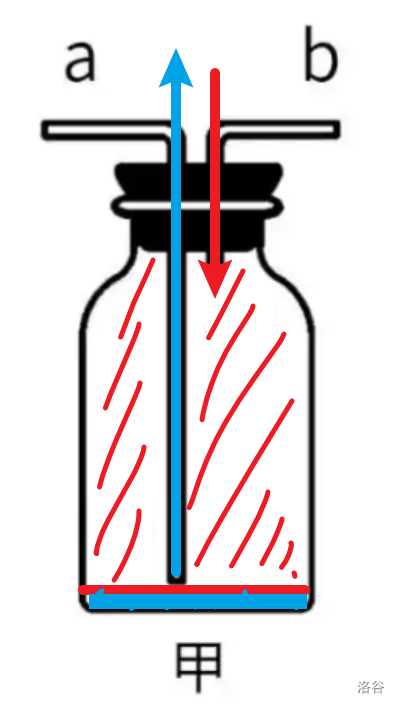
万能收集瓶法
先认识一下万能收集瓶。
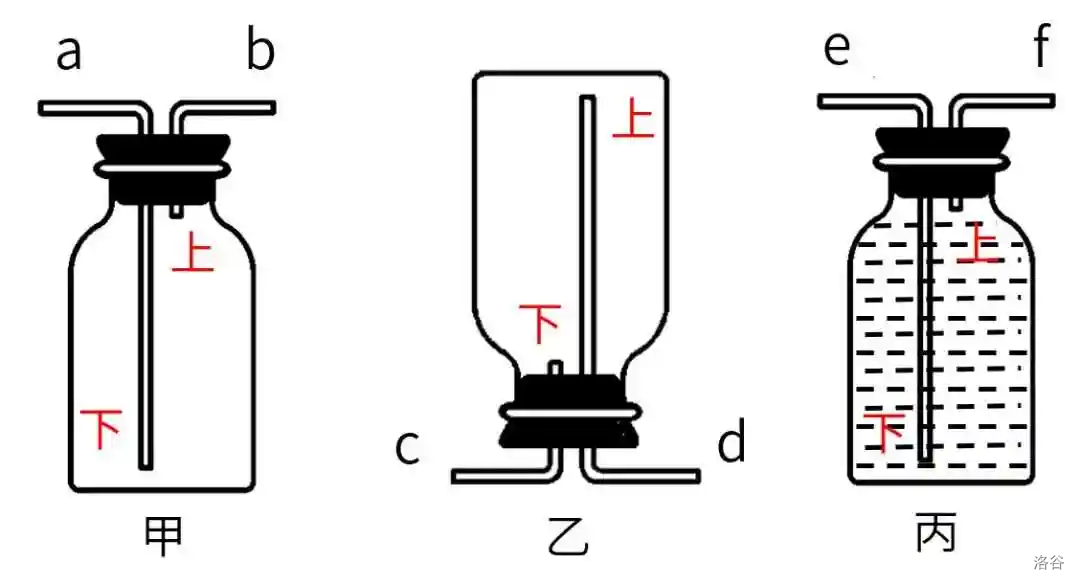
- 甲图用法:“大长小短”。
- 如果气体密度比空气大,气体从\(a\)口进,空气从\(b\)口出。原因可自行理解。
- 如果气体密度比空气小,气体从\(b\)口进,空气从\(a\)口出。原因亦可自行理解。
- 乙图因为倒置,所以“大短小长”。
- 丙图中,无论气体密度大小,因为瓶内是水,所有气体密度都比水小,都从\(f\)口进,水从\(e\)口出。
我曾经有一段时间很不理解,为什么在甲图中气体一定从\(a\)口进,而不是\(b\)口。气体密度大嘛,肯定会把空气压下去的呀,空气自然就从\(a\)口出去了。后来自己做了一个,才明白。画个图,假设现在气体已经快要集满。
看见了吧,下面那一点气体排不出去了,出现了一种诡异的平衡状态!当你抽出导管后,里面的空气就不纯了。
丙图也是一样的道理,里面可能有水残留。另外,甲乙两图都可以收集气体,唯一区别是抽掉导管后,甲图更适用于密度大的,而乙图适用于密度小的。(如果颠倒过来,气体不就跑了吗?)
三种收集方法各有利弊,应该根据气体的性质选择合适的方法。
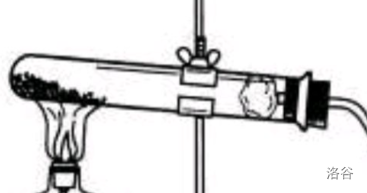
【学生实验】高锰酸钾(\(KMnO_4\))制氧气

步骤说明:
- 连接装置,检查装置气密性(很好检查吧)。
- 向试管中装入适量高锰酸钾,在试管口放一团棉花。集气瓶装满水,用玻璃片盖住倒置在装有水的水槽中。
- 将试管固定在铁架台上。
- 点燃酒精灯,加热!
方法指导:高锰酸钾分解需要较高的温度,酒精灯加热需要一些时间。有的实验会改用酒精喷灯,其原理是将酒精雾化再喷出点燃,温度可达到\(900-1000\degree C\)。 - 当导管口放出的气泡连续均匀时,将导管口伸入集气瓶内,用排水法收集一瓶氧气。(排空气法也可以。这里应该向上还是向下呢?)
- 导管离开水面。盖住玻璃片,并将集气瓶拿出水槽。
- 熄灭酒精灯。(为什么先离开水面后熄灭酒精灯?)
我们取每一个步骤中的关键字,组成“查”“装”“定”“点”“收”“离”“熄”,谐音“茶庄定点收利息”便于记忆。
实验基本注意事项:
- 在试管口放一团棉花:防止加热时试管内的粉末状物质进入导管。(一定写“粉末状物质”!不能写高锰酸钾。)
- 试管略向下倾斜,防止冷凝水回流到【热】试管底部炸裂试管。(一个字都不能少!)
- 酒精灯加热时,先使试管均匀受热,然后对准药品部位集中加热。
- 待导管口放出的气泡连续均匀:高锰酸钾分解出的氧气会先把导管里的空气排尽,因此开始通出的氧气不纯。一定要等到气泡连续均匀再收集,就可以保证集气瓶内基本是氧气。
- 导管先移走(离开水面),再熄灭酒精灯:酒精灯熄灭后,内部气体迅速冷却,气压降低,大气压会把水压入导管。所以,这一步的作用是防止水槽中的水倒吸入试管,使试管因骤冷而炸裂。同时,气压降低还可能使集气瓶内的氧气倒吸回导管,使氧气不纯或不足量。后一个考的不多,前一个务必记住!
其它注意事项:
- 药品要平铺在试管底部,使药品均匀受热。
- 试管内的导管稍稍伸出橡皮塞即可,便于试管内气体排出。
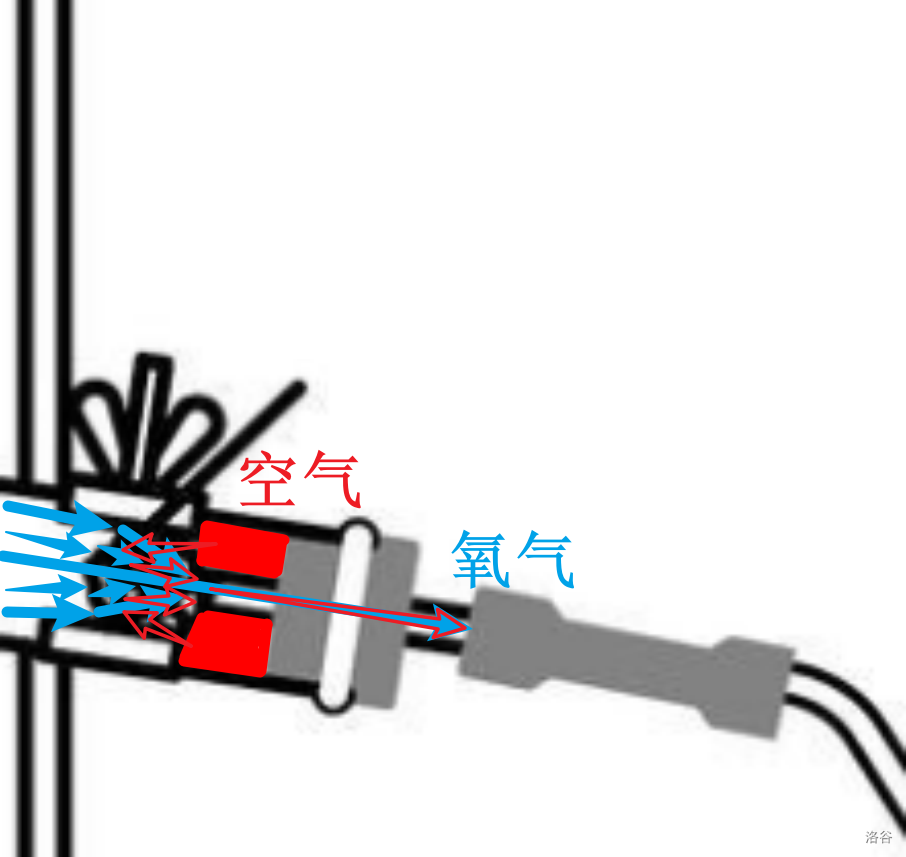
解释:如图,有一部分气体堵在两侧,若混入新制成的氧气,可能导致制得的氧气不纯。
- 铁夹夹在距管口约\(\frac 1 3\)处,更有利于药品加热(不成文的规矩,考试一般不考)。
- 使用排空气法收集氧气时,导管口尽量伸到试管底部。
无奖竞猜:如果希望暂存氧气,则需要将集气瓶(正放 / 倒放)。 - 使用排水法收集氧气时,导管刚伸入集气瓶即可。否则,水不易排出。原理同万能瓶的使用问题。
实验原理:
暗紫色的高锰酸钾固体受热分解为锰酸钾、二氧化锰和氧气。
知识拓展:高锰酸钾并不高
高锰酸钾和锰酸钾相比,明明少了一个钾,怎么反而更“高”了呢?原来,它们的命名方法是这样的:
- 常见的“根”(离子或原子团)包含高锰酸根(\(MnO_4^{1-}\))和锰酸根(\(MnO_4^{2-}\))。
- 由于它们呈酸性,且有锰元素和钾元素,因此两者名字里都有“锰酸钾”。
- 科学家为了区分这两种物质,将锰元素的化合价高的那个定为“高锰酸钾”。以后会学到,\(KMnO_4\)中\(Mn\)是\(+7\)价,另一个则是\(+6\)价,因此得名。
氧气的检验和验满:
- 氧气的检验:将带火星的木条放入集气瓶中,若木条复燃,则瓶内盛有氧气。
- 氧气的验满:将带火星的木条放在集气瓶口,若木条复燃,则氧气已满。
特别地,如果你使用排水法收集氧气,则如果集气瓶口冒出大量气泡,也证明氧气已集满。
【学生实验】过氧化氢(\(H_2O_2\))制氧气
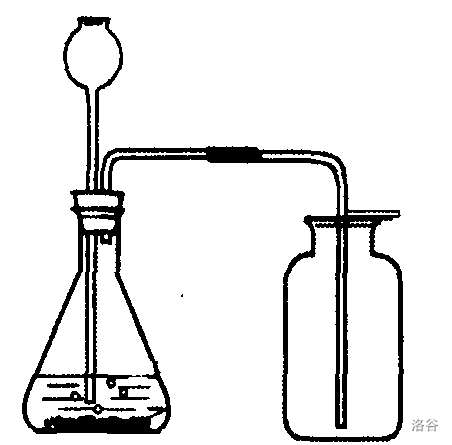
步骤说明:
- 检查装置气密性。
- 向锥形瓶中放入适量二氧化锰(\(MnO_2\))。
- 塞好带有长颈漏斗和导管的橡皮塞。
- 向长颈漏斗中加入过氧化氢溶液。
方法指导:过氧化氢在二氧化锰的催化下,放出大量气泡并膨胀。建议少量多次添加过氧化氢溶液,一次加太多的话后果自负哦! - 用排水法或排空气法收集氧气。
实验原理:
无色透明的过氧化氢溶液(可用于消毒、防腐)分解放出氧气,同时生成水。在二氧化锰的催化下,反应速率大大加快。
催化剂
探究二氧化锰的催化作用:


| 现象 | |
|---|---|
| 实验\((1)\) | 木条不复燃 |
| 实验\((2)\) | 反应剧烈,木条复燃 |
| 实验\((3)\) | 反应依旧剧烈,每次木条都复燃 |
过氧化氢在常温下分解极其缓慢,短时间内用木条根本检验不出来。但是,二氧化锰就像运动会上的啦啦队,使化学反应速率大大加快。而且,二氧化锰好像永远也用不完。
其实,如果你真的把反应前后的二氧化锰收集起来,洗净、干燥、称重,会发现它的质量几乎没变。定量实验已经证明了这一点。不仅质量没变,化学性质也没变,甭管来多少次过氧化氢,它都照样加速反应。
我们将在化学反应中能改变其他物质的反应速率,同时自身的质量和化学性质不发生变化的物质叫做催化剂(\(\text {catalyst}\))。
注意:
- 一个反应中可能有多个催化剂。如过氧化氢制氧气中,氧化铜\(CuO\)、氧化铁\(Fe_2O_3\)甚至红砖(对,就是搬砖的那个砖头)都可以作催化剂。同样的,一个物质在这个反应中能做催化剂,在另一个反应中不一定能。
- 催化剂改变化学反应速率,既可能加快也可能减慢哦。
- 催化剂与生成物的质量和反应是否能发生无关。
- 催化剂在反应过程中的质量或化学性质可能改变,但反应前后一定不变。
分解反应
和高锰酸钾、过氧化氢制氧气一样,由一种反应物生成两种或两种以上物质的反应,叫做分解反应(\(\text {decomposition reaction}\))。它是化学四大基本反应类型之一。


自己看看吧,不难但是考试可能会考。
近几年化学考试竟然都开始考我国的各个科研工作者了,真是紧跟时代潮流啊。相信化学老师会讲的,各位记一记“人物—领域”的对应关系即可,毕竟著名的科研工作者也没那么多。
跨学科实践活动\(1\):微型空气质量“检测站”的组装与使用
随便看看吧。自己看看,除了密度计(因为考试会重点考察),物理的跨学科专题讲过吗?可能最重视的就是语文的综合性学习了吧(也是因为考试要考啊)。

恭喜!你已经学完了化学组需要你预习的部分,而且是远比预习更精细的学习!现在为自己鼓掌吧!
后面肯定还是会更新的,只不过更新的速度可能就要慢一点了。加油!祝你化学马到成功。



 浙公网安备 33010602011771号
浙公网安备 33010602011771号