Nat Struct Mol Biol |深大朱卫国团队乙酰化组学揭示DNA损伤修复重要机制

景杰生物 | 报道
染色质松弛是DNA修复机制进入双链断裂(DSBs)的先决条件。在最初的DSB修复步骤中发生了三个广泛的染色质基础事件:通过核心组蛋白的乙酰化在DSB周围形成开放的染色质结构、凝聚异染色质中的染色质松弛、染色质的快速多聚ADP-核糖基化(PARylation)促进染色质重塑因子负荷。其中,染色质乙酰化是DNA修复通路过程中不可或缺的一部分。然而,DSB周围的局部组蛋白发生乙酰化状态的迅速变化,这个过程如何满足乙酰辅酶A的大量需求尚不清楚。
9月21日,深圳大学朱卫国教授团队在国际顶级期刊Nature Structural & Molecular Biology(IF=16.8)上在线发表了题为“PARylated PDHE1α generates acetyl-CoA for local chromatin acetylation and DNA damage repair”的最新研究成果。研究揭示了染色质相关的丙酮酸脱氢酶1α(PDHE1α)局部产生乙酰辅酶A,以重塑DSB附近的染色质环境并促进其修复的机制,同时也为开发新的癌症疗法提供了潜力。景杰生物为该研究提供了乙酰化修饰组学、质谱分析及乙酰化泛抗体技术支持。

研究发现在DNA损伤处理后,赖氨酸和核心组蛋白乙酰化水平都以剂量和时间依赖的方式短暂增强,且电离辐射(IR)处理后,胞浆和细胞核中乙酰辅酶A的含量增加约2-3倍。此外研究还发现,在该过程中ACSS2和PDHE1α都被招募到染色质上。而后研究者通过邻位连接技术(PLA)等实验进一步验证了PDHE1α在染色质上的募集是DSBs反应中乙酰辅酶A生成和染色质乙酰化的关键。
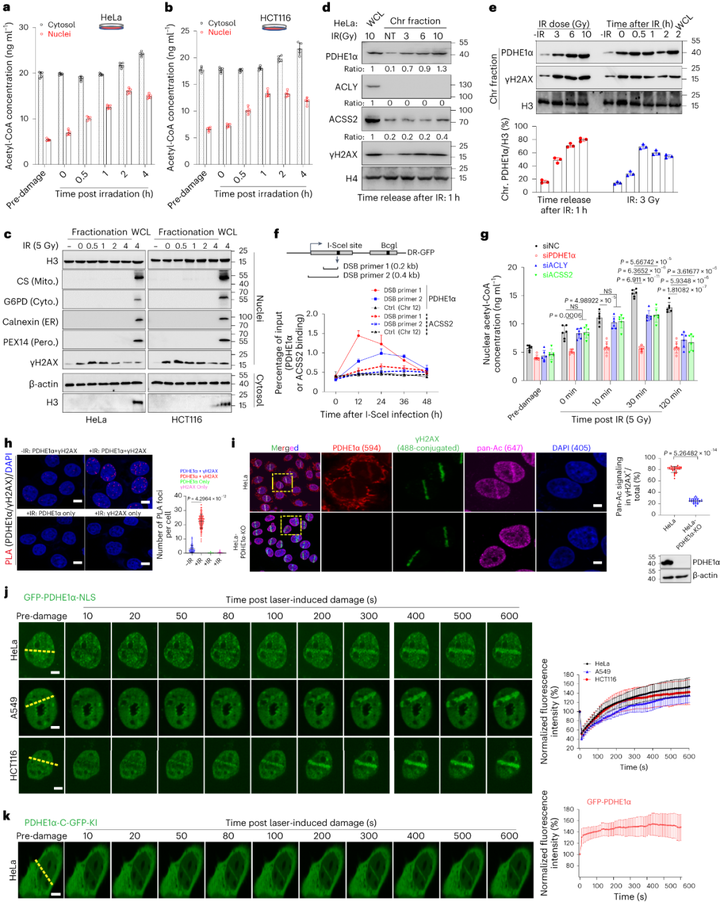
图1 PDHE1α被招募到染色质上,与核乙酰辅酶A的产生和染色质乙酰化一致,以响应DNA损伤
乙酰化组学分析结果发现,在DNA损伤后的DSB位点上,检测到了大量的蛋白质和乙酰化肽,且丙酮酸衍生的乙酰基供体主要是DNA损伤的结果。通过数据库获得的高置信度相互作用评分进一步可视化了检测到的蛋白在DSB上的功能关系,揭示了染色质重组与乙酰辅酶A代谢以及DNA损伤响应(DDR)之间的联系。接下来研究者通过激光诱导DNA损伤检测其中的乙酰化水平变化情况,结果表明,DNA损伤路径上的泛乙酰化信号显著增加,这种效应在很大程度上被PDHE1α的缺失抑制。而后经过同位素标记及运用乙酰化泛抗体进行的ChIP-seq等实验共同验证了PDHE1α介导的乙酰辅酶A的产生是DSB周围染色质乙酰化所必需的。
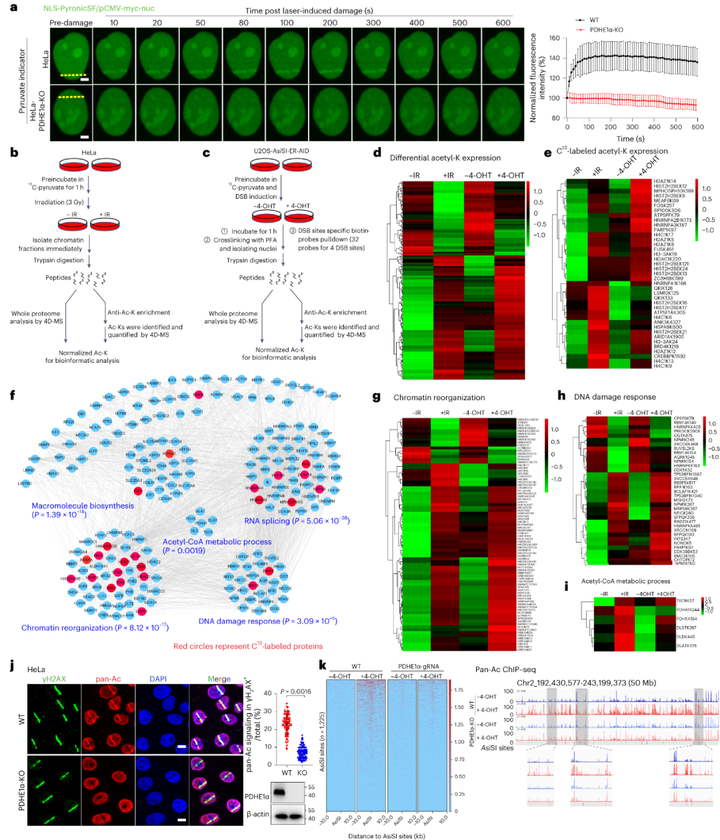
图2 PDHE1α-催化的局部乙酰辅酶A是响应DNA损伤的染色质乙酰化所必需的
为深入理解PDHE1α向染色质募集的调控网络,研究者通过IP-MS和Co-IP实验,验证了PARP1是PDHE1α的互作蛋白。用PARP1抑制剂预处理细胞,结果发现PDHE1α向染色质的募集、二者见的互作效应都显著降低,说明PARP1活性对于PDHE1α募集到DNA损伤位点至关重要。先前研究表明,在DNA损伤的反应中,PARP1被激活与其底物形成多聚ADP-核糖基化聚合物链,这是DSB修复因子募集的先决条件,有利于癌症治疗。因此,研究者通过免疫沉淀等实验进一步验证了PDHE1α在体内和体外都可以通过其上的PAR结合基序,被PARP1多聚ADP-核糖基化,且PDHE1α的多聚ADP-糖基化是其募集到DSB的必要条件。
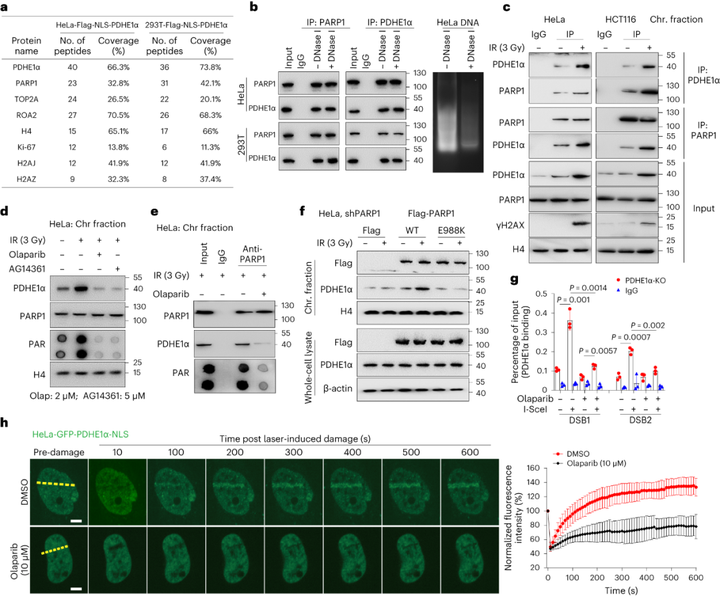
图3 PARP1活性控制PDHE1α在DNA损伤位点的募集
接下来,研究者将PDHE1α PAR结合缺陷突变体恢复到PDHE1α敲除(KO)细胞中,发现这些突变体在PDHE1α酶活性方面没有变化,但在响应IR时,DSB位点的泛乙酰化明显减少。此外,用依托泊苷(etoposide,可抑制DNA合成)处理WT细胞,导致MNase对染色质的可及性增加,而在PDHE1α-KO细胞则没有。同样,在DNA损伤后,PDHE1α缺陷细胞以及PAR结合缺陷的PDHE1α获救细胞中,DSB修复因子的加载能力显著减弱。这些结果表明PDHE1α的多聚糖基化和酶活性是确保DNA损伤后染色质可及性所必需的。
为进一步探究PDHE1α在DNA损伤响应中的功能,研究者采用彗星试验来检测单个细胞中的DNA损伤,结果发现DNA损伤8h后,PDHE1α-KO细胞中DSB病变的比例更高,表明PDHE1α在DSB修复中起重要作用。此外,研究者在细胞内提取了核定位信号(NLS)和核输出信号(NES)标记的构建物来探究PDHE1α分布对DSB修复的影响,结果发现PDHE1α有效地促进了DNA损伤修复,PDHE1α缺乏显著增加了染色体断裂。因此,富含染色质的PDHE1α在促进DSB修复以维持基因组稳定性中起关键作用。

图6 染色质募集PDHE1α促进DNA损伤修复并维持基因组完整性
最后,研究者通过免疫组织化学染色实验发现高PDHE1α表达与高泛乙酰化信号传导呈正相关,二者是基因毒性治疗患者总生存率降低的显著预后因素,说明PDHE1α在基因毒性治疗耐药中具有关键的临床相关性。而后研究者在PDHE1α- KO C57小鼠模型进一步评估了PDHE1α在放射治疗耐药中的作用,结果发现PDHE1α缺陷小鼠((Pdha1f/f; CMVCre)表现出较短的寿命,且与对照组相比,其放射治疗后萎缩的修复延迟,其中的泛乙酰化水平较低,说明PDHE1α的表达在体内赋予细胞抗辐射能力。当PDHE1α PAR结合缺陷突变体注射到裸鼠体内观察其体内皮下肿瘤生长对DNA损伤的反应,结果发现PAR结合缺陷肿瘤对放射治疗的敏感性显著增强,说明染色质PDHE1α在体内肿瘤的放射耐药中起关键作用。
综上所述,研究者通过运用乙酰化修饰组学及质谱分析等手段,揭示了PDHE1α以PARP1催化的多聚ADP-核糖基化修饰依赖的方式快速募集到受损的染色质区域,并催化丙酮酸代谢产生局部乙酰辅酶A,以支持DSBs周围的局部染色质乙酰化,并进一步促进染色质松弛。同时强调了染色质相关的PDHE1α在DSB修复和放射/化疗耐药中的作用。也为开发新的癌症疗法提供了潜力。
朱卫国教授团队长期从事表观遗传学领域的研究,尤其专注组蛋白修饰或组蛋白修饰酶参与DNA损伤应答方面的研究。这次发表的研究是延续组蛋白修饰酶在DNA损伤修复机制上的探索。该团队张俊助理教授为第一作者,朱卫国特聘教授为论文通讯作者。
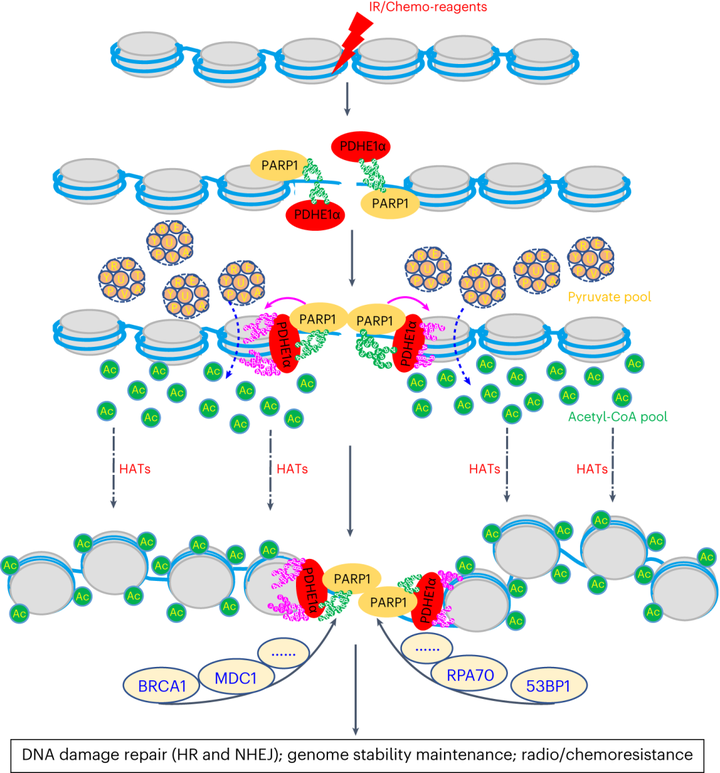
图7 本研究模式图
景杰生物致力于提供权威、专业的蛋白质组学及修饰组学科技服务,拥有高特异性的修饰类泛抗体;高分辨率、高灵敏度的质谱仪;经验丰富的蛋白质修饰组研究团队及生信分析团队。截至目前,项目成果接连见刊于Cancer Cell、Signal Transduction And Targeted Therapy、Molecular Cancer、Nature Genetics等国际顶尖杂志,助力精准医学、免疫组学、动植物科学等领域的创新研究。同时作为蛋白质组学驱动精准医学领域的领军企业,景杰生物凭借卓越的技术储备,搭建赛默飞Orbitrap Astral高分辨率质谱仪,现已推出10K Proteomics超高深度蛋白质组学、修饰组学技术服务,进一步升级单细胞、空间蛋白组、空间磷酸化和超高深度修饰等产品性能,“星舰”计划正式起航,欢迎各位老师前来咨询!!
参考文献 :Zhang J, et al. 2023. PARylated PDHE1α generates acetyl-CoA for local chromatin acetylation and DNA damage repair. Nat Struct Mol Biol.
景杰生物作为修饰组学领域的领跑者,拥有多种修饰抗体和修饰组学质谱检测服务。如果您想了解相关产品和服务的更多信息,请扫描下方二维码填写合作咨询表单、或咨询景杰生物销售工程师、或拨打科服热线400-100-1145。如有转载、投稿等其他合作需求,请在文章下方留言,或添加微信ptm-market咨询。



 浙公网安备 33010602011771号
浙公网安备 33010602011771号