A connectomic study of a petascale fragment of human cerebral cortex
郑重声明:原文参见标题,如有侵权,请联系作者,将会撤销发布!

(2021)
Abstract
我们从大脑皮层的颞叶获得了一个快速保存的人体手术样本。我们用重金属染色1 mm3体积,将其嵌入树脂中,在约~30 nm处切割超过5000个切片,并使用高速多束扫描电子显微镜对这些切片进行成像。我们使用计算方法来渲染包含57216个细胞、数亿个神经突和1.337亿个突触连接的三维结构。1.4 PB的电子显微镜体积、分段细胞、细胞部分、血管、髓鞘、抑制性和兴奋性突触,以及104个手动校对细胞可在线阅读。在这个数据集中,许多有趣和不寻常的特征很明显。胶质细胞数量超过神经元2:1,少突胶质细胞是该体积中最常见的细胞类型。兴奋性多刺神经元占神经元群的69%,兴奋性突触也占大多数(76%)。与抑制性中间神经元(48%)相比,对多刺神经元的突触驱动更强烈地偏向于兴奋(70%)。尽管由于拆分和合并错误导致自动分割不完整,但我们可以在层内和层间的大多数兴奋性和抑制性神经元类型之间自动生成(然后验证)连接。在研究这些神经元时,我们发现深层兴奋性细胞类型可以根据结构和连接性差异分为新的子集,并且枝形吊灯中间神经元不仅如前所述支配兴奋性神经元的初始段,而且还支配彼此的初始段。此外,在每个神经元上建立的数千个弱连接中,存在与目标神经元建立多突触接触(最多约20个突触)的极少数高效轴突输入。我们的分析表明,这些强输入是特定的,并且允许少量轴突在其一些突触后伙伴的活动中发挥巨大作用。
Introduction
虽然与其他动物相比,人类大多数重要器官所执行的功能并没有显著差异,但人类大脑显然将我们与地球上的其他生命区分开来。它是一种极其复杂的组织,迄今为止,人们对其细胞微观结构,尤其是其突触回路知之甚少。这些电路是人类大脑无与伦比的能力的基础,一旦被破坏,很可能是人类大脑功能无法治愈的疾病的基础。阻碍对人脑细胞和回路的详细了解的一个关键障碍是获得高质量的人脑组织。器官活检在许多人体器官系统中提供了有价值的信息,但除了检查或切除肿瘤块外,很少在大脑中进行活检,因此,它们中的大多数对于研究人脑结构的价值不大。此外,对于许多器官系统,来自模式生物的组织对人类疾病很有用:小鼠肝脏或肺可以提供对人类病理生理学的见解。人的大脑是不同的。我们没有很多好的认知和发育障碍模型(尽管这可能会随着对非人类灵长类动物的基因操作而改变1)。此外,人类的大脑显然与老鼠的大脑不同,如果我们按照功能曲目来看,人类与其他灵长类动物有很大的不同。因此,我们必须找到探索人类脑组织本身的方法。一种尝试是使用由人类细胞制成的大脑类器官。这当然是一个有前途的领域2-4但目前它们不接近脑组织结构(例如,不存在皮质层),也没有类似于人脑中的电路。类器官的替代方法是直接方法:使用最先进的工具从人体标本中绘制细胞和电路图。由于对皮质被丢弃或破坏的神经系统进行了神经外科干预,因此可以获得人体标本,因为它阻碍了进入。人体组织是患者神经外科手术的副产品,可以用来了解正常的,也许是紊乱的人体神经回路。此类样本的一个来源是患有耐药性癫痫的个体。这些患者有时会通过脑电图5确定的病灶部位的侵入性手术摘除进行治疗。最常见的局灶性癫痫类型发生在颞叶的内侧,当通过神经外科治疗时,它是通过单侧切除内侧结构,通常包括海马体。内侧结构的进入通常通过横断覆盖的颞叶皮层,有时会去除大量的颞叶(接近半立方厘米)。耐药性癫痫患者人数众多(在美国,约750000名患者),但每年接受癫痫手术的人数很少(0.2%)(Natl. Assoc. of Epilepsy Centers, 2014)。尽管如此,美国每年有1500名患者可能提供组织。
在此,我们描述了这样一个样本,一个立方毫米的体积,它延伸到我们用串行高通量电子显微镜在超微结构水平上成像的所有皮质层,并用计算方法进行分析。以如此大的规模和如此精细的分辨率采集数字人脑组织,不仅可以访问包含数千个神经元和数百万个突触的神经元回路,而且这种体积显微镜还可以清楚地看到构成人类大脑物质的所有其他组织元素,包括所有神经胶质细胞、血管系统以及这些不同细胞类型之间的关系。因此,与人脑生物学相关的广泛问题都可以从单个样本中进行审查。由于数据集很大且审查不完整,为了帮助分析,我们在线共享所有数据。
Results
我们分析的样本来自一位匿名的45岁耐药性癫痫患者,该患者在马萨诸塞州波士顿的马萨诸塞州总医院通过颞前叶进行了左侧海马切除术。传统的神经病理学表明,消融的皮层没有异常,但潜在的海马体硬化并伴有神经元丢失,这在癫痫患者中很典型。
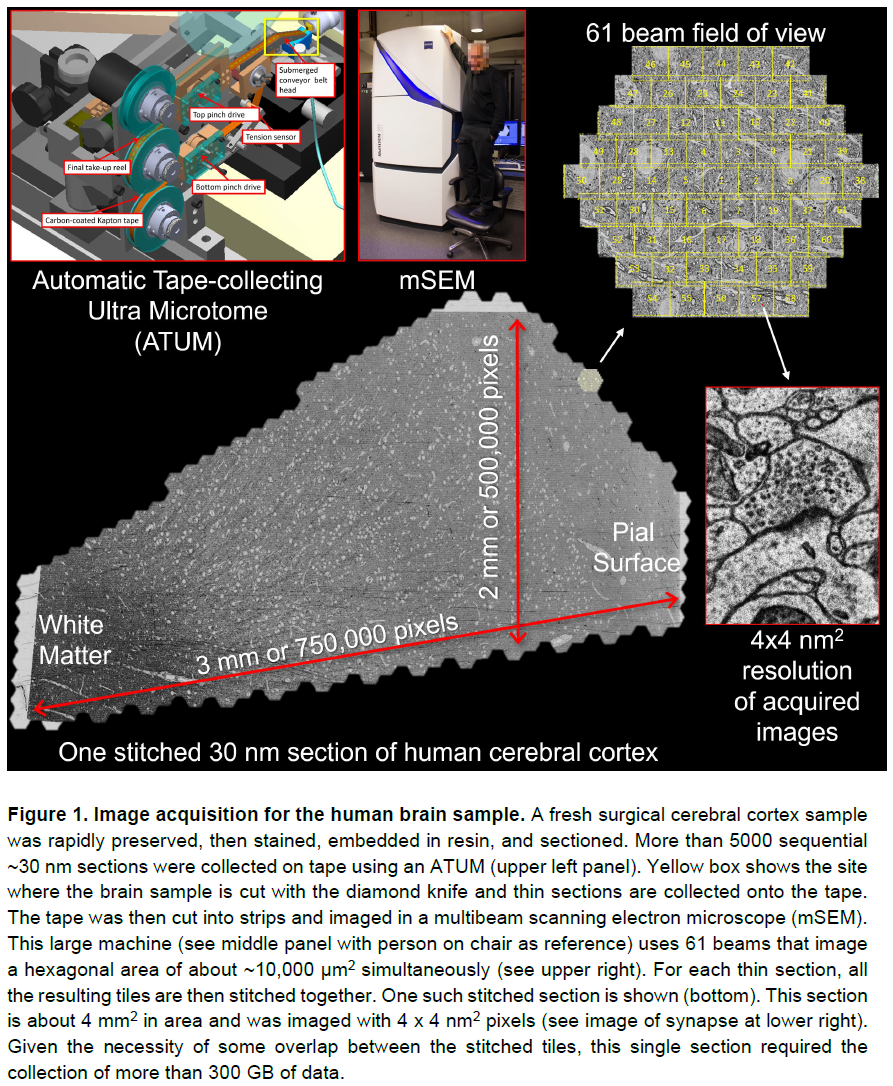
我们通过一系列步骤运行切除的颞叶片段(海马体表层)。我们使用快速浸入固定来出色地保存超微结构。使用ROTO染色方案6进一步保存组织并用锇和其他重金属染色。然后将样品嵌入树脂(epon)块中并修剪。使用自动磁带收集超薄切片机(ATUM; 7),我们以平均33 nm(范围30-40 nm)的切片厚度对5292个片段进行切片,并用多束扫描电子显微镜成像(图1)。使用4 x 4 nm2的像素获取图像。由于切片边缘的必要重叠,原始数据大小高达每个部分350 GB,或者整个部分的集合约为2.1 PB。在示波器采集图像时,定制的工作流程管理器会评估每个图块的质量并标记问题。图像采集的总吞吐量从每秒1.25亿像素到每秒1.9亿像素不等。大部分数据以每秒1.9亿像素的速度采集。1 mm3样品的总成像时间为326天。
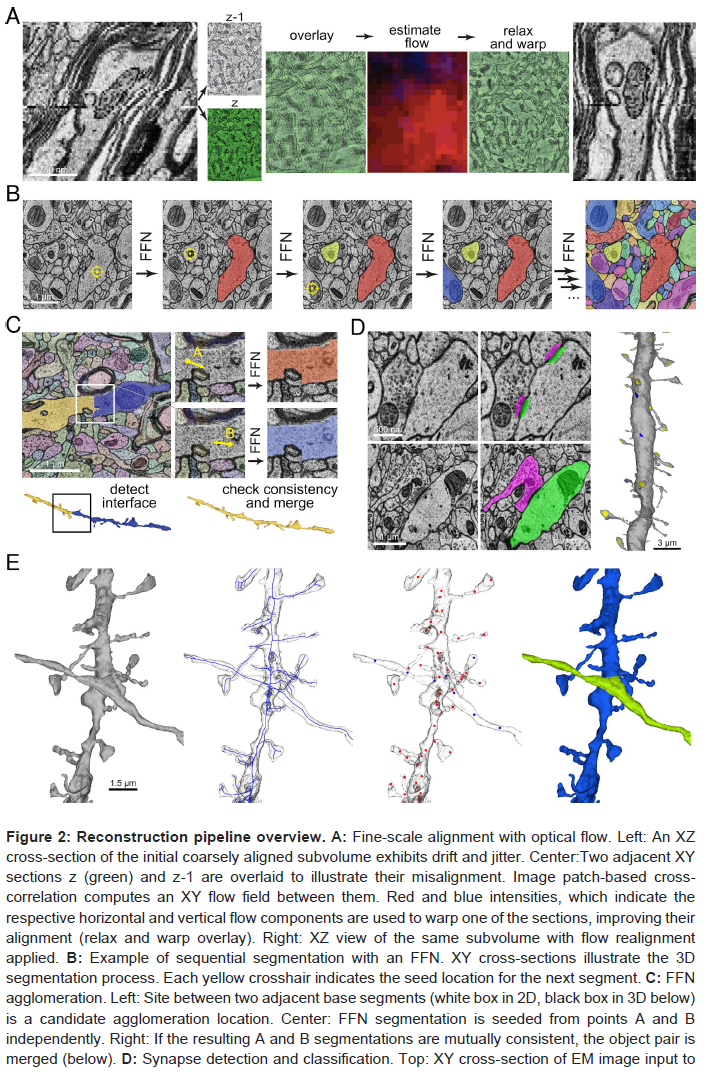
然后将获取的图像数据重新组合成3D细胞对象,从中可以逐项列出所有神经元和神经胶质元素。然后渲染体积中的神经元和穿过体积的神经元过程,并识别它们的突触以产生连接组重建。整个计算密集型过程由一系列高度自动化的工作流程组成(图2,参见方法)。首先将原始获取的图像拼贴拼接在一起,并通过使用显微镜载物台坐标、半自动特征对应和图像补丁互相关进行粗略对齐,以放松每个拼贴和每个部分的弹性三角网格(图2A,左)8。基于相邻部分之间的光流的精细调整对齐从体积中去除了剩余的漂移和抖动(图2A,中心和右侧)。从总共2.47亿个瓦片(2.1 PB)中,1.96亿个包含皮层的tiles (1.7 PB)被缝合、对齐并最终分割,创建了一个统一的~1.4 PB人类大脑皮层图像体积。
通过Flood-Filling Network (FFN)分割和聚集(图2B和C)9。多分辨率FFN分割和过分割共识产生基本片段(也称为超体素,图2B)通过FFN重新分割,然后通过相互一致性标准进行聚集,以产生更完整的重建单元(图2C)。突触连接是通过应用于EM图像块的突触前和突触后掩蔽模型添加的(图2D,顶部),而突触的极性(兴奋性与抑制性)由一个分类模型预测,该分类模型考虑了以每个假定的突触为中心的EM图像,以及局部突触前和突触后神经元段mask,以及突触后位点是否为树突棘(图2D,底部和右侧)。骨架("球和棍子")表示也从体积分割中自动生成,并在自监督神经网络模型的帮助下为骨架节点计算高维嵌入。然后将骨架用于自动子隔室分类,并将嵌入用于神经胶质类型识别。
使用子隔室预测进一步细化了聚集分割(图2E)。分类模型预测轴突、树突、星形胶质细胞、胞体、纤毛和轴突初始节段在骨架节点位置分布在每个细胞中10。偶尔的聚集错误会在附近物体之间产生合并,例如经过的轴突和树突(图2E,最左侧)。我们使用子隔间预测来区分两个合并的对象(图2E,右中)并允许自动切割将它们分开(图2E,最右边)。最终数据集提供了两种不同的聚集:c2聚集有利于更少的中断(因此更长的过程),但错误合并的数量更高,而c3聚集更保守,片段更短,但合并错误更少(两者都可在此处获得)。
为了进行分析,SQL数据库中提供了各种形式的数据,可以对神经元和突触电路数据进行特定查询。我们编写了软件来帮助完成这些查询,包括修改Neuroglancer和一个新程序CREST。
Cellular and Macroscopic Organization
Synaptic Connectivity
New morphological subcategories of layer 6 triangular neurons
Axonal Targeting
Discussion
连接组学的中心原则是捕捉大尺度和小尺度:以足够大的体积重建单个突触连接,以包含神经回路42。我们在这项工作中的目的是研究人类大脑皮层在纳米尺度分辨率下的结构。毫米级的体积,可以看到所有的皮质层和一些白质。为了观察六层皮层之间的皮层内连接,有必要对包含其全部厚度的体积进行成像,在人类(包括这个样本)中,从第1层顶部到第6层底部平均为2.5毫米43。神经元的轴突在形成它们的第一个突触之前可能行进超过100微米44,成像体积的其他两个维度必须足够宽和足够深以追踪皮质内网络连接。我们发现相当于一立方毫米的完整皮质厚度体积为我们提供了足够的组织。需要纳米尺度来识别单个突触并将紧密排列的轴突和树突过程彼此区分开来45。这一大大小小的要求需要采集数万亿个体素,因此需要采集超过1 PB的数字图像数据。这个千万亿次数据集提供了在细胞上、细胞和亚细胞水平上观察相同体积的脑组织以及研究大量神经元、神经胶质和脉管系统之间的关系的机会。最重要的是,它可能让我们一窥人类大脑皮层中许多神经元之间突触关系的巨大复杂性。
这个"数字组织"46是2015年发表的小鼠皮层小区域早期饱和重建的约660000倍放大47。大约与之前的数据集相同的时间(约4年)。这意味着在过去几年中,成像和基于计算机的分析的许多技术障碍得到了显著改善。这种改进在很大程度上归功于两个值得注意的进步:多光束扫描电子显微镜带来的快速成像48以及人工智能对图像处理和分析的深远影响9。过去几年的快速改进49-58表明,分析体积甚至大三个数量级,例如百亿亿级的整个小鼠大脑连接组,很可能会在十年内实现59。
研究人脑样本具有特殊的挑战。幸运的是,H01脑样本的质量与过去使用的心脏灌注啮齿动物样本相当。这有力地表明,将新鲜组织快速浸入固定剂中是一种可行的灌注替代方案,并且在未来的人类连接组学研究中应该特别有用。更成问题的是,来自完全正常个体的新鲜样本不太可能通过这种神经外科途径获得。尽管正如神经病理学家所说,这名患者的颞叶没有表现出明显的异常迹象,但长期癫痫可能对皮质组织的连接或结构有一些更微妙的影响。此外,提供该样本的癫痫患者很可能接受了可能影响大脑结构的药物治疗(尽管成功率有限,因此进行了手术)。然而重要的是,我们获得的神经外科标本本身并不是病理过程的一部分,它被移除只是因为它"挡道"——也就是说,如果不移除它,外科手术就无法完成。鉴于手术后成功结果的患者具有正常的脑功能,假设该程序确定了异常,并且剩余的大脑功能正常。正常运作的大脑可能包括偶然切除的组织。然而,只有通过比较从患有不同基础疾病的患者获得的样本,我们才能最终了解这个样本是否正常。我们在这个组织中发现了一些奇怪的东西,但目前我们无法确定它们是病态的还是不寻常的。这些包括许多非常大的刺和充满不寻常物质的轴突静脉曲张(参见补充图7)。
来自联合皮层的人脑组织面临的另一个挑战是,它可能是由于经验而建立的电路的位置。如果记忆存储在人类大脑的这一部分,那么另一个大脑不太可能是相似的,例如,多个秀丽隐杆线虫的大脑是定型的。60但即使在同基因蠕虫中,40%神经元到神经元的连接在样本之间是不同的。鉴于人类经验、行为、记忆和遗传学的变异性要大得多,而且人类和其他脊椎动物拥有已确定的神经元类别而不是单个已确定的神经元类型,因此比较大脑之间的神经回路无疑将具有挑战性。这一挑战也提供了一个机会:揭示学习信息的物理实例化。即使电路在细节上有所不同,也有可能通过查看足够的数据来发现记忆的元逻辑,也许在未来的"图形学"领域61,62。可以肯定的是,揭示神经回路连接数据意义的深刻问题的方法还处于起步阶段,但在我们看来,取得进展的最佳刺激可能是大量的实际数据——这个PB级数据集是 一个开始。
然而,我们已经意识到大数据会引发没有现成答案的大问题。尽管分割正在迅速改进,但自动重建的电路远非完美。分割错误和合并错误之间的紧张关系意味着,根据目标,人们可能更喜欢提供更少分割错误或更少合并错误的分割(我们在网上分享了两个聚集体,它们都是这两种选择,c2和c3)。在此示例中,我们使用更高级别的语义注释来消除一些合并错误,例如修剪星形胶质细胞或合并到树突树的轴突。这些更高级的机器学习方法可能会非常有用,因为它们在未来几年会变得完善。在当前的自动化精度水平下,手动纠正H01这么大的体积中的所有分割错误是不切实际的。然而,当我们仔细检查这些数据中的分割错误时,它们几乎总是继发于图像采集中的缺陷,例如关键部位的染色伪影、由于厚度变化导致的对齐困难,或拾取到磁带上的部分变形。我们怀疑改进的组织切片和染色方法可能有助于减少未来的错误数量。
对大数据进行连接组学研究的一个优势是,在小样本中可能很难找到的罕见事件在更大的数据量中表现出来。长期以来,人们已经认识到树突树允许神经元从数千个不同的神经元中收集信息,如本研究所示。因为绝大多数这些连接是弱的(约99.9%有1个或最多4个突触),因此已经假设神经处理必须通过整合恰好在大致同时处于活动状态的多个弱输入的空间和时间总和来进行。然而,我们发现,在大量弱轴突连接中,有一些输入是异常值,在突触后神经元的树突上形成十个甚至二十个突触。由于它们的共同起源,这些多个释放位点确保一个输入将同步激活目标细胞,可能足够强到超过阈值(如果是兴奋性的)或能够阻止活动(如果是抑制性的)。在更小体积的校对小鼠体感皮层中,我们之前看到轴突在同一个树突上产生多达五个突触,这似乎也不是偶然发生的,也许暗示稀疏的强大输入可能是一个普遍的特征 哺乳动物的大脑。
几年前,神经心理学家63提出运动学习发生在三个阶段:认知、联想和自主。关键是,在运动任务的早期很难完成,并且需要大量的认知努力,但最终它会在没有考虑的情况下发生(例如,新手驾驶员在看到红灯时学习使用制动踏板,而不是经验丰富的驾驶员自动和几乎无意识的制动)。显然,一旦完全学习了一项任务,人脑就可以更快地做出决定。这怎么可能发生?一种可能性是加强一条通路,使其不那么依赖多种来源的总和,如果一个输入能够自行激活目标细胞,就可能发生这种情况。有趣的是,这是运动系统最后肢体的成熟策略64,65。在年轻的动物(可能包括人类)中,神经肌肉接头受到许多弱运动轴突的支配,此时可能需要同时激活多个轴突以引起可靠的肌纤维抽搐。随着时间的推移,这些输入中的许多被消除,剩余的轴突通过添加更多的突触释放位点来补偿66。剩余的输入足够强,能够可靠地激活肌肉纤维,因为有二十个或更多的释放位点的高量子含量。这种强化也发生在中枢神经系统(CNS)中,例如一种攀爬纤维对抑制性突触后神经元(Purkinje细胞)的强烈兴奋性输入。这种多突触释放也出现在一组较弱的攀爬纤维输入被消除并且剩余的轴突增加了许多突触之后67。联合皮层是否有可能通过增加突触允许一些输入成为活动的自主驱动因素?如果是这样,那么这种连接在更年轻的人类大脑中应该会更不常见。
长期以来的假设是,人类神经科学必须利用比动物模型中的问题更不直接、更难解决的方法。特别是,人们假设虽然有可能获得啮齿动物大脑皮层或果蝇或蠕虫的中枢神经系统中所有细胞的完整接线图和结构细胞类型分析,但类似的壮举会 在人类中是不可能的。但是,如果要克服人体标本的技术障碍,对人体标本进行这些相同类型的分析不是更有意义吗?在患有精神疾病或发育障碍的人类标本中这样做不是特别重要吗?这里提供的千万亿次数据支持这样一种观点,即精细连接组学是学习人类大脑的可行途径。
Data availability
Code availability
Statistics
Methods
Sample acquisition and preparation
Sample sectioning
Estimation of tissue compression introduced during ultrathin sectioning
Wafer fabrication and mapping
EM image acquisition
EM image quality checks
Image Alignment, Stitching and Rendering
Stitching.
Alignment correspondences.
Alignment transforms.
Rendering.
Fine-scale alignment with optical flow.
Semantic segmentation
Valid tissue detection.
Voxel-wise classification.
Neuron and glial segmentation
Base segmentation.
Agglomeration
Pairwise resegmentation.
Endpoint resegmentation.
Ensembling.
Soma and fragment type separation
Skeletonization of segments
Cellular subcompartment classification and merge error correction
Subcompartment classification.
Merge error correction.
Subcompartment rendering.
Spine detection.
Embeddings
Manual cell body labeling and classification
Manual labeling of blood vessels and their nuclei
3D rendering of cells
Synapse identification
Synaptic site detection.
Prediction filtering and connectome assembly.
Correction of synapse over-splitting.
Excitatory versus inhibitory synapse classification
Measurement of synapse prediction errors
Correction of segmentation errors by computer-assisted proofreading
Analysis of manual and ML-generated neuronal networks
Identification of cortical layers
Identification of neuronal clusters.
Fitting boundaries to neuronal clusters.
Measurement of synapse densities
Measurement of layer 5 and 6 triangular cell basal dendrite angles
Analysis of axon partners of layer 5 and 6 triangular cell basal dendrites
Analysis of axonal selectivity
Identification of distinct axonal skeleton components.
Estimation of distributions of distances from synapse to axonal shaft.
Simulation of random connectivity of an individual axon.
Analysis of axonal selectivity.
Analysis of information flow through network



 浙公网安备 33010602011771号
浙公网安备 33010602011771号