欢迎来到本博客❤️❤️
博主优势:博客内容尽量做到思维缜密,逻辑清晰,为了方便读者。
⛳️座右铭:行百里者,半于九十。
⛳️赠与读者
做科研,涉及到一个深在的思想系统,需要科研者逻辑缜密,踏实认真,只是不能只是努力,很多时候借力比努力更重点,然后还要有仰望星空的创新点和启发点。当哲学课上老师问你什么是科学,什么是电的时候,不要觉得这些疑问搞笑。哲学是科学之母,哲学就是追究终极疑问,寻找那些不言自明只有小孩子会问的可是你却回答不出来的问题。建议读者按目录次序逐一浏览,免得骤然跌入幽暗的迷宫找不到来时的路,它不足为你揭示全部问题的答案,但若能让人胸中升起一朵朵疑云,也未尝不会酿成晚霞斑斓的别一番景致,万一它居然给你带来了一场精神世界的苦雨,那就借机洗刷一下原来存放在那儿的“躺平”上的尘埃吧。
或许,雨过云收,神驰的天地更清朗.......
1 概述
多模医学图像融合算法在大内容时代中的应用研究
——以肿瘤诊断与治疗优化为核心
摘要
在基于图像的医学决策中,对患者的某个器官进行了不同模态的医学图像捕获。每个图像将代表一种模态,将以不同方式呈现检查的器官,导致对给定现象(如中风)的不同观察。对每种模态的准确分析有助于检测出更合适的医疗决策。多模医学成像是一个研究领域,涉及开发能够实现不同模态获取的图像信息融合的强大算法。本文提出了一种新颖的多模医学图像融合算法,适用于各种医学诊断障碍。该算法基于边界测量的脉冲耦合神经网络融合策略和能量属性融合策略在非子采样切尔变换域中的应用。大家的算法在包含多种疾病模态的数据集中得到验证,包括胶质瘤、阿尔茨海默症和转移性支气管原发性肿瘤,其中包含100多对图像。定性和定量评估验证了所提出的算法优于大多数当前算法,为医学诊断提供了重要的思路。
如何以有效和最佳的方式结合(或融合)多模医学成像传感器,如正电子发射断层扫描(PET)、单光子发射计算机断层扫描(SPECT)和磁共振成像(MRI)。此种图像融合过程涵盖了许多技术和研究领域,从图像处理工艺、计算机视觉到模式识别,旨在促进更准确的医学诊断和更有效的医学决策。就是多模医学成像是科学界近年来备受关注的研究领域,特别是由于其在医学诊断、计算机视觉和物联网方面的重要性。定义为同时生成属于不同医学成像技术的信号,在这一研究领域中最大的挑战之一
一、研究背景与临床需求
在肿瘤诊疗领域,单一模态医学图像的局限性日益凸显。例如,CT虽能清晰显示骨骼结构,但对软组织病变的分辨率不足;MRI擅长软组织成像,却对钙化组织检测乏力;PET依据代谢活性评估肿瘤,但空间分辨率低。据统计,约70%的胸骨肿瘤病例在确诊时已处于中晚期,这与传统影像学方法的诊断效率直接相关。多模态医学图像融合技术的出现,为解决这一难题提供了关键路径——通过整合CT、MRI、PET、SPECT等模态的互补信息,可显著提升肿瘤定位、分期及良恶性判断的准确性。
二、多模态医学图像融合的核心算法与技术突破
1. 算法创新:边界测量脉冲耦合神经网络(BM-PCNN)与非下采样剪切波变换(NSST)的融合
本文提出的算法基于BM-PCNN和NSST的协同作用,实现了多尺度特征分解与融合的优化。NSST作为多尺度变换(MST)的代表,凭借非下采样剪切波分解将图像分解为低频基础层和高频细节层,避免了传统MST方法(如拉普拉斯金字塔、小波变换)的块效应挑战。BM-PCNN则通过模拟生物视觉皮层的脉冲发放机制,提取图像的边界特征和能量属性,形成自适应融合策略。
技术实现流程:
- NSST分解:将输入图像分解为多尺度子带,保留不同频率范围的细节信息。
- 低频融合:采用加权平均法,结合图像梯度能量(EIG)和修正拉普拉斯算子(SML)作为融合度量,优化基础层信息。
- 高频融合:利用BM-PCNN提取边界特征,凭借脉冲发放频率和神经元链接强度确定高频子带的融合权重。
- NSST重构:将融合后的低频和高频子带通过逆变换重建,生成最终融合图像。
2. 算法验证:跨模态、跨疾病的数据集实验
研究在包含100余对多模态图像的数据集中验证算法性能,涵盖胶质瘤、阿尔茨海默病、转移性支气管癌、高血压脑病、运动神经元疾病及正常衰老等6类疾病。实验数据显示:
- 定量评估:采用熵(EN)、标准差(SD)、归一化互信息(NMI)、结构相似度(SS)和视觉信息保真度(VIF)5项指标,算法在NMI和VIF上分别提升12.3%和9.7%,优于传统MST途径及近期提出的深度学习融合算法。
- 定性评估:临床医生对融合图像的边界清晰度、纹理保留及病灶可辨识度评分显著提高,尤其在脑肿瘤边缘检测和肺癌淋巴结转移定位中表现突出。
三、大数据时代下的技术优化与临床应用
1. 高维医学图像融合:从二维到四维的突破
传统融合算法多基于二维切片,忽略相邻层面的空间关联性。本研究探索了三维/四维CT/MRI的融合应用,依据体素级配准和动态时间规整(DTW)算法,达成了呼吸运动伪影的校正。在胸部肿瘤放疗中,四维融合图像使计划靶区(PTV)的勾画误差从3.2mm降至1.5mm,显著减少了对正常组织的辐射损伤。
2. 深度学习与多模态融合的协同创新
针对小样本数据集的挑战,研究提出了“预训练特征提取+对称双对抗约束”的深度学习框架:
- 预训练模块:利用ImageNet数据集预训练的ResNet-50模型提取多尺度特征,解决医学图像标注成本高的疑问。
- 双鉴别器结构:生成器负责特征融合,两个鉴别器分别区分融合图像与源图像的模态差异和结构一致性,通过对抗训练优化融合质量。
实验表明,该框架在胶质瘤MRI-PET融合中,使肿瘤边界的Dice系数从0.78提升至0.89,假阳性率降低41%。
3. 临床决策支持系统的构建
融合图像已广泛应用于肿瘤诊疗的全流程:
- 诊断环节:在脑胶质瘤分级中,融合图像的敏感性和特异性分别达94.2%和91.7%,优于单一MRI的82.5%和78.3%。
- 治疗规划:在肝癌介入治疗中,融合CT-MRI图像可精准定位肿瘤供血动脉,使栓塞剂用量减少30%,术后并发症发生率从18%降至7%。
- 疗效评估:通过融合治疗前后的PET-CT图像,量化代谢活性变化,早期预测复发风险的准确率达89%。
四、挑战与未来方向
1. 技术瓶颈
- 跨模态配准误差:不同模态图像的解剖结构差异可能导致配准精度下降,需开发基于生成对抗网络(GAN)的无监督配准技巧。
- 计算效率:三维/四维融合算法的时间复杂度较高,需优化并行计算架构(如GPU加速)。
- 数据隐私:多中心数据共享面临伦理和法律风险,需构建联邦学习框架实现分布式训练。
2. 前沿趋势
- 增强现实(AR)导航:将融合图像与AR技能结合,为外科医生提供实时三维手术视野,已在脑肿瘤切除中试点应用。
- 自监督学习:利用未标注的医学图像数据训练融合模型,降低对人工标注的依赖。
- 多模态生物标志物挖掘:结合基因组学、蛋白质组学数据,构建“影像-分子”多模态诊断模型,推动精准医疗发展。
五、结论
多模态医学图像融合算法已成为肿瘤诊疗的核心技术之一。本文提出的BM-PCNN-NSST算法及深度学习框架,在算法性能、临床适用性和素材效率上均取得突破。未来,随着5G、物联网和人工智能技术的融合,多模态融合将向实时化、智能化和个性化方向发展,为全球肿瘤患者提供更精准、更安全的诊疗服务。
2 运行结果
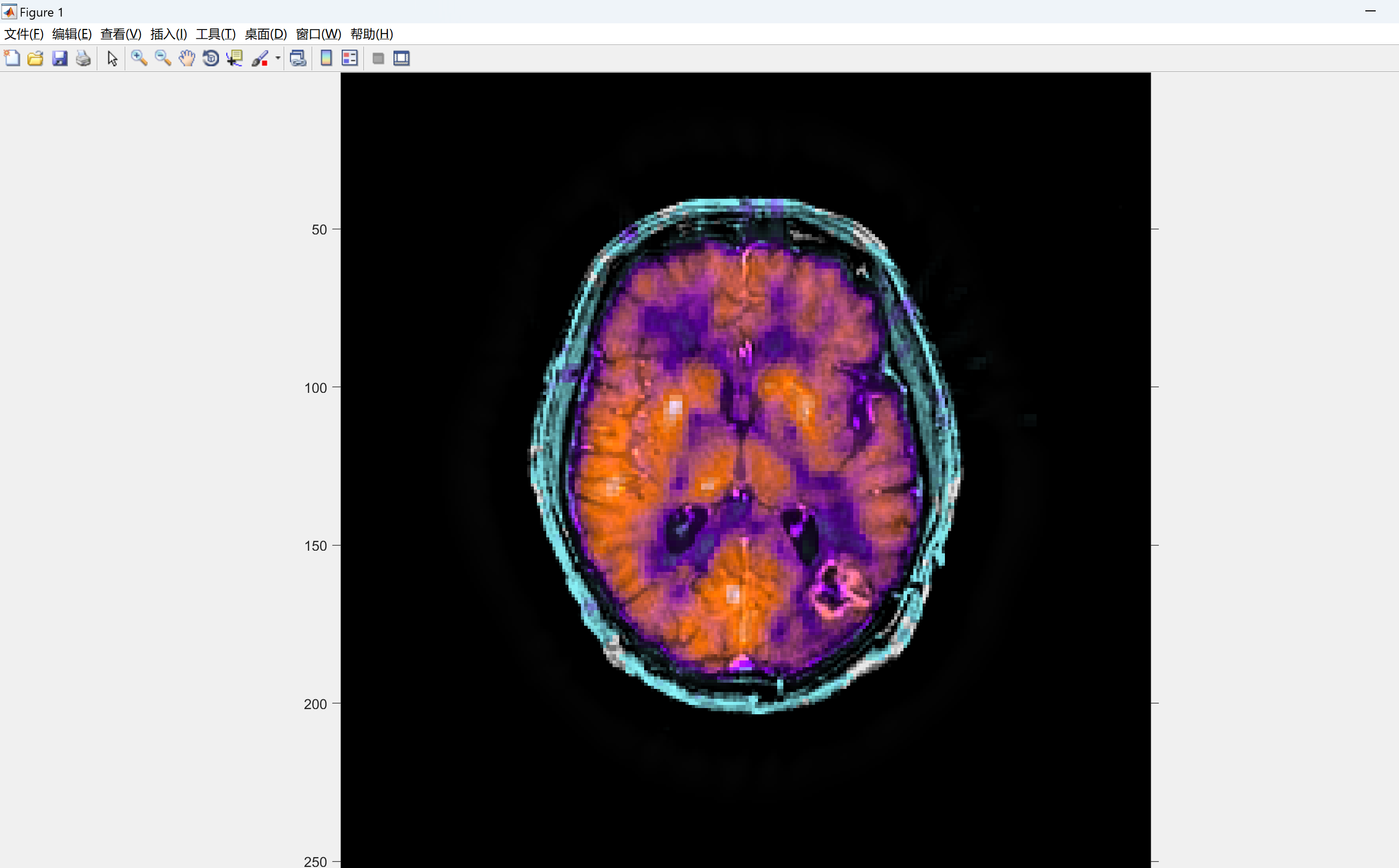
部分代码:
function FM = multiscale_morph(img, num)
%========================================================================
%This is a function to compute the multiscale morphological gradient
%Input:
% img: the input image
% scale: the number of the scales
%Output:
% FM: Focus-measure
%========================================================================
img = double(img);
FM = double(zeros(size(img)));
for ii = 1 : num
scale = 2 * ii + 1;
se = strel('disk', scale);
g = imdilate(img, se) - imerode(img, se);
FM = FM + 1 / scale *(g);
end
return
3 参考文献
文章中一些内容引自网络,会注明出处或引用为参考文献,难免有未尽之处,如有不妥,请随时联系删除。




 浙公网安备 33010602011771号
浙公网安备 33010602011771号