【whk】高考 / 应试有机化学
高考有机
1 课本纵向概述
这里的内容注定非常应试,虽然有的东西并没有讲明白什么道理,但是要应试没有办法。如果你真的想要系统学习这些反应的机理,我建议你去学 Clayden 或者学《基础有机化学》,前者汉化版好像目前只有盗版,但是内容更加通俗。
我尽量会写一点。
这里省略了“有机物的一般研究方法”,后面有。默认你会写有机物的六式,知道 \(\rm Et-\) 是乙基,\(\rm Me-\) 是甲基。如果你对键线式还不够熟悉,我建议你写题的时候多写一点,这样你就会对他产生依赖,因为现在写结构简式我都嫌烦。
1.1 物质结构
这里列一个提纲。
- 原子结构:洪特规则,泡利不相容原理,构造原理,能量最低原理。
- 元素周期律
- 分子结构:共价键,键能比较,共价键的键角,极性;VSEPR(价层电子对互斥模型);杂化轨道理论;离域 \(\pi\) 键;分子的手性;分子间作用力。
- *四大晶体(注:这一部分内容和有机关系不大)
- *配位键(注:这一部分内容与有机有点关系,但不会在有机大题进行考察)
1.2 烃类
烷烃
- 取代反应在下面卤代烃有,这里额外提一句,取代反应更容易在 \(\rm C-H\) 更少的碳上进行。
- 注意物理性质,这一块的物理性质算是高考考点。
烯烃
- \(\rm X_2/HX/H_2/H_2O\) 加成
- 二烯烃加成 \(1,2 / 1,4\) 加成
- 马氏规则
- 加聚反应 / 高分子的书写
- 氧化反应:针对 \(\rm KMnO_4(H^+)\) 环境下的,对碳碳双键进行氧化的反应:如何产物反推原反应物?
- DA 成环:\(1,3\)-丁二烯和乙烯反应生成环己烯。
炔烃没啥好说的。
专题:
- 原子共平面 / 共线问题
- 同分异构体书写,这一专题会在之后的学习逐步扩大。
1.3 卤代烃
分类:\(K\) 元卤代烃表示有 \(K\) 个卤原子。\(K\) 级卤代烃表示所连碳原子连接的 \(\rm C-C\) 键数量。
课标反应:
作为反应物:
- \(\rm EtBr+NaOH\xrightarrow[]{H_2O, \Delta} EtOH+NaBr\)(水解)
- \(\rm EtBr+NaOH\xrightarrow[]{EtOH, \Delta} CH_2=CH_2+NaBr+H_2O\)(消去)
说明:
- 反应 1 是所有卤代烃的通性。
- 反应 2 的要求:存在 \(\beta\) - 氢原子,也就是相邻位置的碳原子上直接连有的氢原子。当然必须指出链接在苯上的氢原子是没办法被消去的。
- 同时如果卤素原子连在了碳链中间,也就是非一级卤代烃,那么就会有多种产物。
- 二元卤代烃可以引入三键或两个双键。
作为生成物:
- \(\rm CH_2=CH_2+HCl\xrightarrow[]{Catalyst, \Delta}EtCl\)(加成)
- \(\rm CH_2=CH_2+Cl_2\xrightarrow[]{Catalyst, \Delta}CH_2ClCH_2Cl\)(加成)
- 什么玩意?\(\rm\begin{cases} \rm CH_4+Cl_2\xrightarrow[]{light}CH_3Cl+HCl\\\rm CH_3Cl+Cl_2\xrightarrow[]{light}CH_2Cl_2+HCl\\\rm CH_2Cl_2+Cl_2\xrightarrow[]{light}CHCl_3+HCl\\\rm CHCl_3+Cl_2\xrightarrow[]{light}CCl_4+HCl\\\end{cases}\),不用这个制取,因为杂质太多。
- 合成题中,卤代烃往往作为中间桥梁,用来后续引入羟基。
- 这里举例用了氯,实际合成多见溴。
实验:检验溴代烃中的溴原子
卤代烃的卤原子显然不可能被电离,所以通过氢氧化钠把它弄成卤化钠。
Step 1:取少量卤代烃于试管。
Step 2:加入氢氧化钠水溶液
Step 3:加热
Step 4:一段时间过后冷却
Step 5:加入稀硝酸酸化(作用 1:\(\rm NaOH + HNO_3=NaNO_3+H_2O\),排除 \(\rm OH^-\) 的干扰;作用 2:看生成的沉淀是否溶于稀硝酸)
Step 6:加入硝酸银
然后注意沉淀颜色可以看出是什么原子,\(\rm AgCl,AgBr,AgI\) 都沉淀而且颜色逐渐变深。不过真的会有碘原子吗,碘甲烷都已经是强致癌物了(\(\rm CH_3I\) 可以攻击你的 DNA)。
1.4 醇
官能团:\(\rm -OH\)。
课标反应:
作为反应物:
- \(\rm 2EtOH+2Na\xrightarrow[]{} 2EtONa +H_2\uparrow\)(反应不如水剧烈,因为 \(\it Et-\) 给电子。\(\it K, Ca, Mg, Al\) 均可发生类似反应)
- \(\rm EtONa+H_2O\xrightarrow[]{} EtOH + NaOH\)
- \(\rm EtOH+HBr\xrightarrow[]{\Delta}EtBr+H_2O\)(取代)
- \(\rm MeCOOH+EtOH\overset{浓硫酸,\Delta}\rightleftharpoons MeCOOEt+H_2O\)(酯化)
- \(\rm 2EtOH\xrightarrow[]{浓硫酸, 140^\circ C}Et_2O+H_2O\)(脱水)
- \(\rm EtOH\xrightarrow[]{浓硫酸, 170^\circ C} CH_2=CH_2\uparrow+H_2O\)(消去)
- \(\rm EtOH\xrightarrow[\Delta]{Cu, O_2} MeCHO\xrightarrow[]{KMnO_4(H^+) / K_2Cr_2O_7 (H^+)} MeCOOH\)(催化氧化)
- \(\rm 2 (CH_3)_2CHOH+O_2\xrightarrow[\Delta]{Cu}2(CH_3)_2C=O+2H_2O\)(催化氧化二级醇 - 变成酮)
说明:
- 反应 7.1 的铜是催化剂,经历了有到无再到有的过程,所以现象就是固体红变黑变红。
- 反应 7.1 的要求是在 \(\alpha\) - 碳上有氢原子,所以三级醇没法发生该反应。
- 反应 7.2 可以用来测酒驾,重铬酸钾可以做滴定试剂。
作为生成物:
- \(\rm EtBr+NaOH\xrightarrow[]{H_2O, \Delta} EtOH+NaBr\)
- \(\rm MeCHO + H_2\xrightarrow[]{Catalyst., \Delta} EtOH\)
- \(\rm CH_2=CH_2+H_2O\xrightarrow[]{Catalyst, \Delta} EtOH\)
实验:消去反应
把 \(\rm 15mL\) 浓硫酸加到 \(\rm 5mL 95\%\) 的乙醇中,冷却,倒入长颈圆底烧瓶,缓缓放入碎瓷片(防止暴沸)。
迅速(减少乙醚生成)加热到 \(\rm170^\circ C\),把生成的气体通入氢氧化钠(除去二氧化碳,二氧化硫),通入高锰酸钾酸性溶液(褪色),通入溴的四氯化碳溶液(褪色)。
1.5 酚
定义:羟基和酚直接相连。
课标反应:
- 弱酸性。\(\rm PhOH + Na_2CO_3 \xrightarrow[]{} PhONa + \bf {NaHCO_3}\) 原因是酸性:\(\rm H_2CO_3>PhOH>HCO_3^-\)
- 羟基对苯环的影响导致与 \(\rm Br_2\)(溴水)加成反应时只能加成邻、对位置。这个反应非常灵敏,产物沉淀,所以可以用来定量测定。
- 强还原性,很容易和高锰酸钾反应使之褪色;很容易和氧气反应生成粉红色物质。
- 与氢气加成变成羟基环己烷:\(\rm PhOH+3H_2\xrightarrow[]{Catalyst, \Delta} C_6H_{11}OH\)
- 可以和 \(\rm FeCl_3\) 发生显色反应(紫色)。
这个好像没什么要解释的。
1.6 醛
官能团:\(\rm -CHO\)。可以和水形成氢键。
乙醛的密度比水小。
课标反应:
- \(\rm MeCHO + H_2\xrightarrow[]{Catalyst., \Delta} EtOH\)(催化还原 / 加氢)
- \(\rm MeCHO + HCN \xrightarrow[]{} MeCH(OH)CN\)
- \(\rm 2MeCHO \xrightarrow[]{Catalyst.} MeCH(OH)CH_2CHO\xrightarrow[-H_2O]{Catalyst. \Delta} MeCH=CHCHO\)
- \(\rm MeCHO + 2[Ag(NH_3)_2]OH\xrightarrow[]{\Delta} 2Ag\downarrow + MeCOONH_4 + 3NH_3 + H_2O\)(基于银镜反应对醛基的定性定量检验)
- \(\rm MeCHO + 2Cu(OH)_2+NaOH\xrightarrow[]{} MeCOONa + Cu_2O\downarrow + 3H_2O\)(氧化反应。氢氧化铜必须是新制的。现象:蓝色絮状沉淀,加热之后砖红色沉淀。此为斐林试剂检验还原糖的原理)
- 可以让高锰酸钾褪色,可以让重铬酸钾变绿,可以让溴水褪色(氧化还原),不可以让溴的四氯化碳溶液褪色。
说明:
- 反应 1 的催化加氢反应产物一定是一级醇。
- 反应 2 产物命名为 2 - 羟基丙腈,因为氰基的命名优先级更高。顺便说一句这个反应相当有工业生产价值和理论研究启发性,应该算是有机化学的经典反应之一。
- 反应 3 是甲基上的 \(\alpha\) - 氢原子和醛基加成反应变成 \(\beta\) - 羟基醛。脱水之后会生成不饱和醛。
- 甲酸(酯)也有醛基,所以不能说有醛基就是醛。
实验:银镜反应和醛基的检验。
前面一半的注意点比较多,但是在选二已经讲过了。
1.7 酮
与醛基的氢有关的反应(不能被银镜、氢氧化铜氧化)均不能进行,与碳氧双键有关的性质(可以形成氢键;可以催化加氢;可以与氢气、氢氰酸加成)依旧存在。
1.8 羧酸
酸性:乙酸 > 碳酸 > 苯酚。
证明它:
- \(\rm 2HAc +Na_2CO_3\xrightarrow[]{} 2NaAc + H_2O + CO_2\uparrow\)(我们可以在饱和碳酸氢钠环境下进行这个实验,这样就可以让水蒸气,二氧化碳充分进入后续装置;同时可以除去 \(\rm HAc\) 蒸汽)
- \(\rm H_2O + CO_2 + PhONa \xrightarrow[]{} PhOH + NaHCO_3\)
酸脱羟基醇脱氢:
- \(\rm RCOOH + R_1OH \overset{浓硫酸, \Delta}\rightleftharpoons RCOOR_1+H_2O\)
这里顺带提一下酰胺的制取:
- \(\rm RCOOH + NH_3 \xrightarrow[]{\Delta}RCONH_2+H_2O\)
考但不是课标反应:
- \(\rm RCH_2COOH \xrightarrow[]{LiAlH_4} RCH_2OH\)(强行还原)
- \(\rm RCH_2COOH+Cl_2\xrightarrow[\Delta]{Catalyst.} RCHClCOOH + HCl\)
1.9 酯
\(\rm RCOOR'\),其中 \(\rm R\) 可以是氢,这时候它叫做甲酸某酯。
课标反应:
- 可以反过来水解(酸性条件、可逆反应)。\(\rm RCOOR'+H_2O\overset{稀硫酸, \Delta}\rightleftharpoons RCOOH + R'OH\)
- 可以反过来水解 2.0(碱性条件、完全反应)。\(\rm RCOOR'+NaOH\xrightarrow[]{\Delta} RCOONa+ R'OH\)
关于油脂的内容就是纯背书,和生物没啥区别。
感觉全会了高考题随便做,那种为了难而难的模拟题多练也能做。
2 横向总结 + 说明
这里先偷一张图:
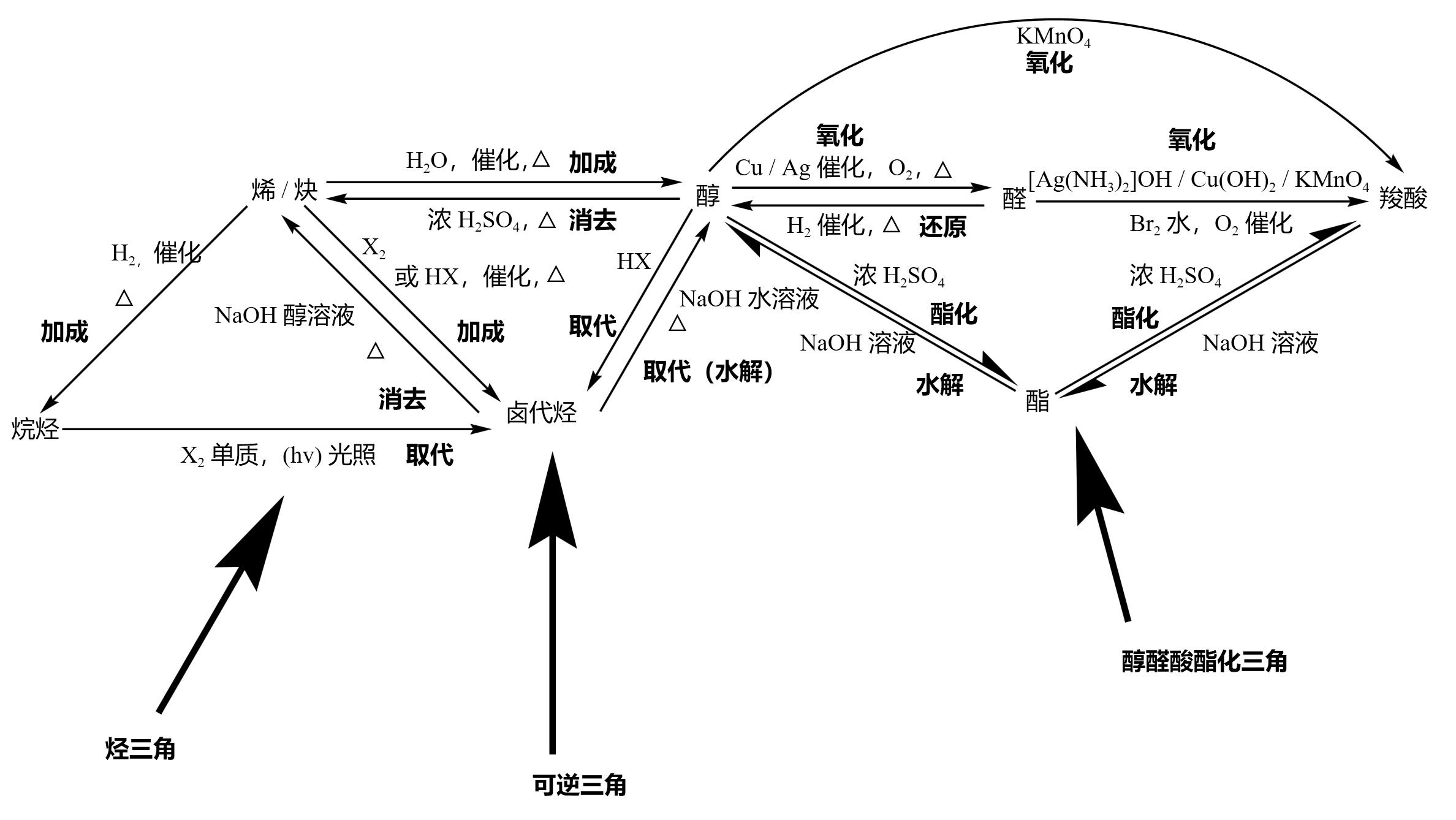
这里必须声明的时高考对有机反应条件的重视性,书写设计合成路线题的时候一旦中间一步的条件是错的后面将会一分不得。当然本身在有机合成当中反应条件就是很重要的,有时一些细微的温度变化会引起产物的巨大改变,很多时候反应是否发生,温度是否有利于反应发生,取决于各个混合体的熔沸点高低。
在你实际操作起来各种选择题的时候就会感到迷惑,因为他喜欢给你一个有机物问你能不能发生相关反应,这里进行一个总结。
- 可以与溴水反应的:碳碳双键(加成反应)、碳碳三键(加成反应)、苯酚(可以用来鉴定的反应,生成沉淀)、醛基(强氧化性导致的)。
- 可以与溴单质(液溴)反应的:碳氢键(光照加热才行),碳碳双键(加成反应)、碳碳三键(加成反应)、苯(铁离子作为催化剂的取代)、苯的同系物(光照或铁离子,后者同苯,会在邻位、对位取代)、苯酚(同上)、醛基。
- 可以被酸性高锰酸钾氧化的:碳碳双键(切断,变成两个羰基;如果切断之后直接连有氢原子还会变成羧基。但是臭氧氧化不会变成羧基,而是直接切断变成羰基)、碳碳三键、苯的同系物(会变成苯某酸)、醇(催化氧化成醛)、醛(弱氧化剂即可氧化成羧酸)、苯酚。这里出现了苯酚、苯的同系物,唯独没有苯
- 区分可以发生氧化反应和可以被酸性高锰酸钾氧化:前者直接烧,全都可以烧。
- 可以发生加成反应的:碳碳双键、碳碳三键、苯(只能是氢气)
- 可能可以发生消去反应的:醇、卤代烃。(一定要判断是否满足条件!!)
- 可以和氢氧化钠发生反应的:卤代烃、酯、羧基、苯酚。
从上面你可能发现了苯的侧链基团对苯的性质还是有很大影响的。因为上面没有提到,所以补充一点:对于甲苯的硝化,是可以轻松变成 \(2,4,6\) - 三硝基甲苯(TNT)的,苯则不然。苯的取代主要是一元取代,甲苯的取代则是邻位、对位的取代。这是侧链基团对苯的影响。反过来说,苯对侧链基团也有影响。\(\rm Ph-CHRR'\) 可以被高锰酸钾氧化成苯甲酸,当然那两个基团就掉下来了。苯环会让烷基更容笔被氧化。
题型补充:消耗氢气 / 溴水的量
氢气
- 醛基 / 羰基催化加氢:一对一(注意不是看到双键就加氢,羧基和酯基是不能加氢的)
- 双键加成:一对一;三键加成:一对二
- 苯环直接加三个变成环己烷(但是一定看清是不是苯环!如果怕错就一个双键一个双键地数)
溴水
- 前面已经特别声明过了,但这里还是要再提一遍:溴水没法发生关于碳氢键的取代,那个需要液溴和光照。
- 但是溴水也可以发生取代,但是必须在苯环上,而且是酚羟基的邻对位(不是空的当然不行,多个酚羟基可以取代多个邻对位,譬如邻苯二酚可以取代四个溴原子)。
- 不要忘了加成。双键(必须是碳碳双键)可以消耗一个溴水,三键就是两个。
对于可能会出现的简单有机合成题,从“可逆三角”到“醇醛酸脂化三角”的是常规套路。不过这里还是要提一下格氏试剂。
格氏试剂,通俗的理解就是可以把羰基拼到烷基上。这里不讲机理了。
- \(\rm RBr + Mg \xrightarrow[]{乙醚} RMgBr\)
- \(\rm RMgBr + R_1R_2C=O\xrightarrow[]{} R_1R_2RCOMgBr\xrightarrow[]{H_2O} R_1R_2RC-OH\)
算了,你能看懂就行,因为不是很想插入图片。多做一些这样的题目这样不用看材料就可以直接写出来合成路线了。
这个可以算是最近高考的热点。
3 有机实验一般回答思路;
3.1 有机物的相关物理性质综合
熔沸点
当作分子晶体比。
- 优先级最高:氢键,这个应该在选择性必修二就讲过了,列举一下:羟基、羧基、氨基。注意 \(\rm CH_3NH_3\) 没有任何分子间氢键。
- 优先级次高:比谁重,范德华力越大
- 如果都一样,可以比极性,极性大,熔沸点大;支链少,熔沸点大。
溶解度
我们一般说溶解度说的是在水中的溶解度。
- 规则一:相似相溶。苯甲酸难溶于水,因为对称性太高,极性不够。
- 规则二:看氢键,羟基、氨基、羧基、巯基。这些基团叫做亲水基团。相反的,烃基,酯基就疏水。
- 规则二补充规则:自己和自己形成氢键有的时候会和和水形成氢键相互竞争。\(\rm B(OH)_3\) 可以和自己形成氢键,每个硼酸都连有三根氢键,但这就让硼酸晶体扔到水里面的时候水无处下手。但是稍稍加热就可以让硼酸改而和水形成氢键。(当然这里也有溶解平衡的因素在,两个因素共同作用了)碳酸氢钠溶解度小于碳酸钠亦然。
- 结论:碳越多溶解度越低。三个碳以内的含亲水基团有机物一般都可以任意比例溶解。但是碳一多,尽管有亲水基团也没用。看起来很溶的醛基、羧基、如果有超过十二个以上的碳,都可以称得上是难溶。
密度,与水比较
这个就是主要看不溶于水的液体放进去谁在上面。
- 烃基、酯类、苯的同系物小于水。
- 卤代烃大于水,碳越多密度越小。
- 硝基苯大于水。
别的题目应该会给。
气味
- 羧酸碳少的时候味道有点冲,挥发性强(实验题考虑除去)
- 苯及其同系物有奇香,但是有毒,非常有毒,但是是良好的有机溶剂,可以把溴从溴水里面萃取走。
- 苯酚有毒,有腐蚀性,弄到身上要用乙醇清洗
(应该没人会用氢氧化钠清洗吧?)。
3.2 有机物的除杂
括号里面是杂质
- 同系物杂质:直接蒸馏
- 卤代烃和所对应烃之间也可以这么干。
- 乙烷(乙烯、乙炔):用溴水洗一下,后者加成产物沸点较大。
- 乙烷(乙醇):从水里过,乙烷是液体的话就分液。
- 硝基苯(浓硝酸):加水分层
- 作为无机反应物或者催化剂与有机产物分离的典型:通过无机反应或者无机溶解分层。
- 乙醇(水):加入生石灰然后蒸馏。
- 乙醇(乙酸):蒸馏,通过碱石灰。
- 乙酸乙酯(乙酸、乙醇)饱和碳酸钠溶液
- 苯(苯酚):氢氧化钠反萃取。
说明:
- 聪明的你可能会用水分离苯和溴苯,但事实上苯和溴苯是互溶的,水不能轻易地拆开这个体系。
- 对于错误的(利用化学反应的)除杂,往往是:1. 和两个都反应 2. 和两个都不反应 3. 只反应一个,但是产物还是没法除去,或者多个产物中有没出去的 4. 反应一个,但是难以和另外一个分离。 5. 被体系外因素影响:比如蒸馏要考虑被蒸馏物会不会被氧化。
3.3 常见工艺操作
上面已经提到萃取了。
萃取
这不仅是有机的内容,也会在工艺流程大题中考察,而且是重难点,区分度设计点。
萃取剂的选择
- 与原溶剂不相溶,不反应;
- 溶质在萃取剂中的溶解度远大于原溶剂的,不与溶质反应;
- 从实用价值考虑:容易回收利用,沸点不高。
最简单的实验是溴的萃取。步骤:
- 溴水加入梨形分液漏斗。
- 萃取剂(四氯化碳)加入梨形分液漏斗,此时现象分层。
- 振荡(一定检漏)
- 静置一会
- 分液。从上下分别倒出。
结晶,重结晶
重结晶是很简单的道理,一次不够多来几次。利用的是杂质溶解度不够或者很大,这决定了我们留下析出物还是留下液体。
主要是要考虑你的温度控制。不能太高,一方面是花钱,一方面是不能沸腾了或者氧化了产率降低,但是有的时候又必须趁热过滤,因为只有在这个温度下才能分离,降温会导致杂质重新溶解 / 析出。
4. 有机物的同分异构体书写
会和合成题抢最后一问的题型。要你书写往往就比较难,同分异构体可能就只有一两种,可操作性小;但是如果要你数数,就比较容易缺漏。如果你有基本的数学素养就不应该数重,在开始学的时候一定要搞清楚同种物质的判定,以及题目有的时候会说不考虑顺反异构,立体异构肯定不考虑,因为旋转下来就有无穷多种了,因为有优势构象让立体结构偏向于稳定,所以一般我们就不考虑。
这个可能比较需要例题,暂时还没有。




 浙公网安备 33010602011771号
浙公网安备 33010602011771号