一个中考化学的复习 / 黑帽衫遮住脸 怯懦躲开视线
lsy 个人向记录。中考化学 ++rp;「」\(\xlongequal{}{}\)
stO cxy Orz / stO jyx Orz / stO sjy Orz / stO gxx Orz ...,膜一下增加 \(rp\)
重要化学人物 & 成就:梁可馨发明创造了一切!!(实际考试基本是无脑选中国人吧,但是万一选项不止一个中国人呢。
道尔顿「原子论」,门捷列夫「元素周期表」,拉瓦锡「测定空气成分 / 验证质量守恒定律」,侯德榜「发明联合制碱法」,张青莲「测定几种元素相对原子质量的新值」,屠呦呦「青蒿素」。
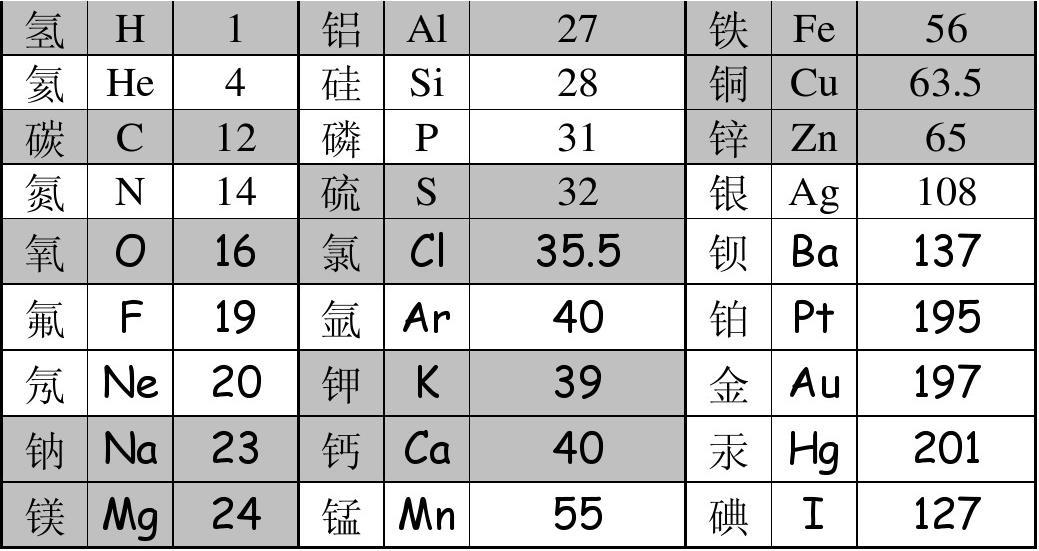
一单位的相对原子质量表示 \(\frac{1}{12}\times 一个碳-12 的原子质量\)。
空气的相对分子质量为 \(29\)。
第 \(x\) 层核外电子的个数上限 \(2x^2\),特别的最外层为 \(8\)。
化学性质跟核外电子排布尤其是最外层有关。
最外层电子数 \(<4\) 容易失去电子,最外层电子数 \(>4\) 容易得到电子,对于最外层电子放满(\(H\) 最外层有 \(2\) 个或者最外层有 \(8\) 个电子)的情况,不易得失电子。
元素周期表 \(H,He,Li,B(铍),Be(硼)/C,N,O,F,Ne/Na,Mg,Al,Si,P/S,Cl,Ar(氩),K,Ca\)。
常见稀有气体 \(He,Ne,Ar\)。
常见阳离子/正价 \(+5: P / +4: Si / +3: Al / +2: Ca,Mg,Ba,Cu,Zn / +1: K,Na,Ag,H,NH_4^+\),亚铁 \(+2\),铁 \(+3\),碳 \(+2 / +4\)。
常见阴离子/负价 \(-1: Cl,OH^-,NO_3^-(轻笑) / -2: O,SO_4^{2-} ,CO_3^{2-} / -3: N,PO_4^{3-}(磷酸根)\)。
元素周期表 横行 为周期,纵列 为 族,同一周期核外电子层数相同,前三周期最外层电子数依次递增,同一族元祖(\(He\) 除外)最外层电子数相同,化学性质相似(\(H\) 除外),同一周期从左到右依次是 金属元素 / 非金属元素 / 稀有气体元素。
不同元素的本质区别在于「质子数不同」。
地壳中质量分数排名前 \(4\) 的元素:\(O,Si,Al(金属),Fe\)
金属一般指具备特有光泽(即对可见光强烈反射)而不透明、具有延展性及导热导电性的一类物质。
元素之最:\(C(碳)\) 形成化合物种类最多,\(O\) 在生物细胞中含量最多,\(Ca\) 是人体中含量最高的金属元素,\(Fe\) 年产量最高的金属,\(H_2O\) 相对分子质量最小的氧化物,\(Cu\) 人类最早大规模使用的金属,\(Ag\) 导电/热性最好的金属,\(H_2\) 密度最小的气体,\(CH_4\)最简单的有机物,\(W/Hg\) 熔点最高/低的金属。
化学式的含义:一种物质 / 一种物质的元素组成 / 物质的一个分子 / 物质的分子构成。
基本反映类型:化合 \(A+B+...\to X\),分解 \(X\to A+B+...\),置换 \(A(单质)+BC(化合物)\to AC(化合物)+B(单质)\),复分解 \(AB+CD\to AD+CB\),双交换,价不变。
空气成分:\(78\% N_2 / 21\% O_2 / 0.94\% 稀有气体 / 0.03\% CO_2\)。
\(O_2\) 密度略大于空气,不易溶于水。工业制取:分离液态空气法(利用沸点不同)。
高锰酸钾制取氧气 \(2KMnO_4\xlongequal{\Delta}K_2MnO_4+MnO_2+O_2\uparrow\)。
氯酸解制取氧气 \(2KClO_3\xlongequal[\Delta]{MnO_2}2KCl+3O_2\uparrow\)。
过氧化氢制取氧气 \(2H_2O_2\xlongequal{MnO_2}2H_2O+O_2\uparrow\)。
\(CO_2\) 无色无味,密度比空气大,能溶于水(体积约 \(1:1\))。一般不燃烧也不支持燃烧,不能供给呼吸,没有毒。与水反应生成碳酸 \(CO_2+H_2O\xlongequal{} H_2CO_3\):正常雨水呈弱酸,碳酸很不稳定易分解 \(H_2CO_3\xlongequal{} CO_2\uparrow+H_2O\)。澄清石灰水检验二氧化碳 \(CO_2+Ca(OH)_2\xlongequal{} CaCO_3\downarrow+H_2O\),氢氧化钠吸收二氧化碳 \(CO_2+2NaOH\xlongequal{} Na_2CO_3+H_2O\)。
工业制取二氧化碳,锻造石灰石 \(CaCO_3\xlongequal{高温}CaO+CO_2\uparrow\)。
实验室制取二氧化碳,大理石、石灰石与盐酸反应 \(CaCO_3+2HCl\xlongequal{}CaCl_2+CO_2\uparrow+H_2O\),不能用稀硫酸的原因 \(H_2SO_4+CaCO_3\xlongequal{}CaSO_4+H_2O+O_2\uparrow\)。
\(H_2\) 密度小于空气,难溶于水,无色无臭,具有可燃性,还原性 \(H_2+CuO\xlongequal{\Delta}Cu+H_2O\)(黑色固体变红,试管口有水珠产生)。
氢气燃烧,\(2H_2+O_2\xlongequal{点燃}2H_2O\),安静地燃烧,发出淡蓝色火焰,放出热量,照在火焰上方的干冷小烧杯内壁出现水雾。验纯:收集一小管氢气用拇指堵住试管口,靠近酒精灯火焰,移开拇指点火,如果发出尖锐爆鸣声则表示气体不纯,不纯会爆炸哦 ~
氢气的制取 \(Zn+H_2SO_4\xlongequal{} ZnSO_4+H_2\uparrow\)。
\(CO\) 无色无味密度略小于空气,难溶于水,具有点燃性(点燃前要验纯),还原性,毒性:极易与血液中的血红蛋白结合使之失去携氧能力造成 Hypoxia。
铁丝燃烧 \(3Fe+2O_2\xlongequal{点燃}Fe_3O_4\),红热、不燃烧 / 剧烈燃烧、火星四射、放出大量的热、生成黑色固体。在杯底放少量水/铺沙防止高温熔融物炸裂瓶底。
镁条燃烧 \(2Mg+O_2\xlongequal{点燃}2MgO_2\),剧烈燃烧发出耀眼的白光,放出热量,生成白色固体。
铜丝加热 \(2Cu+O_2\xlongequal{\Delta}2CuO\),铜丝表面变黑。
硫燃烧 \(S+O_2\xlongequal{点燃}SO_2\),发出微弱淡蓝色火焰 / 发出明亮蓝紫色火焰 & 放出热量,生成有刺激性气味的气体。在杯底放 \(H_2O,NaOH\) 液体吸收反应生成的 \(SO_2\),防止污染空气。
木炭燃烧 \(C+O_2\xlongequal{点燃}CO_2\) 持续红热 / 发出明亮的白光 & 放出热量,生成能使澄清石灰水变浑浊的气体。
红磷燃烧 \(4P+5O_2\xlongequal{点燃}2P_2O_5\),发出黄色火焰 / 发出白光 & 发出热量,产生大量白烟。可以测定空气中氧气的体积分数,可以换成 \(S\) 但是要把水换成 \(NaOH\)。
一氧化碳燃烧,\(2CO+O_2\xlongequal{点燃}2CO_2\),发出蓝色火焰,放出热量,生成能使澄清石灰水变浑浊的气体。
天然气燃烧,\(CH_4+2O_2\xlongequal{点燃}CO_2+2H_2O\),发出蓝色火焰,罩在火焰上方的干冷小烧杯内壁出现水雾,生成能使澄清石灰水变浑浊的液体。
电解水 \(2H_2O_2\xlongequal{通电}2H_2\uparrow+O_2\uparrow\),正氧负氢,氧一氢二(理想气体的体积比等于分子中原子数比),预先在水中加入少量硫酸钙或氢氧化钠可以增强导电性。
固体加热发生装置:试管口略向下倾斜,导管伸入稍过橡胶塞即可,高锰酸钾制取氧气时试管口放棉花(防止高锰酸钾的粉末进入导气管),排水法收集气体应先将导管溢出水面再熄灭酒精灯,防止试管倒吸入液体破裂。
固液/液液常温型发生装置的常用装置评价:操作简便 / 便于随时添加药品 / 能控制反应速率获得平稳气流 / 随时控制反应发生和停止,注意事项:长颈漏斗下端管口应插入液面以下防止生成的气体从长颈漏斗口逸出。
排水法收集注意事项:观察到试管口有气泡连续均匀地放出时开始收集。
水的净化 \(取水\to 加入絮凝剂(明矾)吸附沉降\to 反应沉淀池 \to 过滤池\to 加入活性炭除异味、色素\) \(\to 活性炭吸附池 \to 清水池\to 通入Cl_2消毒杀菌 \to 生活用水\)。
硬水/软水:含有较多/没有或较少可溶性 \(Ca,Mg\) 化合物的水,鉴定方法:取样分别加入等量肥皂水振荡,产生浮渣多、泡沫少的是硬水反之是软水,硬水软化:生活中煮沸实验室中蒸馏。
物质分为纯净物(单种物质)和混合物,纯净物分为单质和化合物,化合物分为有机物和无机物。通常带 \(C\) 的是有机物(\(CO,CO_2,H_2,CO_3,碳酸盐,碳酸氢盐\) 除外),相对分子质量较小/大的分别称作有机小/大分子化合物,总称有机物。无机物的主要类别,氧化物 :氧元素和另一种元素组成的化合物,酸/碱:在水解离出的阳/阴离子全都是 \(H^+/OH^-\) 的化合物,盐:含有金属离子或铵根离子和酸根离子的化合物,酸式盐:\(金属离子+酸根离子+H^+\),碱式盐:\(金属离子+酸根离子+OH^-\)。
物质的颜色:黑色 \(C,Fe粉,CuO,MnO_2,Fe_3O_4\),紫红 \(Cu\),红棕 \(Fe_2O_3\),浅绿 \(Fe^{2+}溶液\),黄 \(Fe^{3+}溶液\),蓝 \(Cu^{2+}\) 溶液。沉淀物的话,白色 不溶于稀硝酸的盐 \(BaSO_4,AgCl\),溶于酸的难溶性碱 \(Mg(OH)_2\),溶于酸的难溶性盐 \(CaCO_3,BaCO_3\),蓝色 溶于酸的难溶性碱 \(Cu(OH)_2\),红褐 \(Fe(OH)_3\)
俗称与成分:生石灰 \(CaO\),熟石灰/消石灰 \(Ca(OH)_2\),烧碱/火碱/苛性钠 \(NaOH\),纯碱/苏打 \(Na_2CO_3\),小苏打 \(NaHCO_3\),干冰 \(固态 CO_2\),酒精 \(C_2H_5OH\),水银 \(Hg\),蓝矾/胆矾 \(CuSO_4·5H_2O\),胃酸 \(HCl\),天然气/沼气 \(CH_4\),食盐 \(NaCl\),大理石/石灰石 \(CaCO_3\),石灰水/石灰浆 \(Ca(OH)_2\),铁锈/赤铁矿 \(Fe_2O_3\),磁铁矿 \(Fe_3O_4\),炉具清洁剂 \(NaOH\),厕所清洁剂 \(HCl\),醋酸 \(CH₃COOH\)。
酸碱性质的判断,\(酸+石蕊(紫) \to ?(红)\),\(酸+酚酞(无色)\to?(不变色)\),\(碱+石蕊(紫)\to?(蓝)\),\(碱+酚酞(无色)\to?(红色)\)
盐酸 \(HCl\) 易溶于水,浓盐酸试剂瓶打开瓶口出现白雾。
浓硫酸 \(H_2SO_4\) 具有强腐蚀性(脱水性),生成黑色的炭,也有吸水的物理性质。碳:非金属元素,炭:木材在隔绝空气的条件下干馏得到的东西。
浓硫酸的稀释:将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里(不能将水加入浓硫酸因为水密度更小浮在上面,溶解放热使其沸腾导致硫酸液滴飞溅),用玻璃棒不断搅拌(加快散热),实在不小心应先冲洗再涂上碳酸氢钠溶液(小苏打,弱碱)。
硝酸,“烟硝烟” 指挥发出的硝酸溶于空气中的水蒸气所形成的酸雾,化学性质不稳定,见光受热易分解且浓度越大越易分解 \(4HNO_3\xlongequal{光照/\Delta}2H_2O+4NO_2\uparrow+O_2\uparrow\),棕色玻璃瓶避光,\(NO_2\) 融入其中浅黄色,本身无色易挥发有刺激性气味。
碳的单质:金刚石、石墨、\(C_{60}\),石墨灰黑色、质软、有滑腻感、有优良的导电性,\(C_{60}\) 分子形似足球。他们物理性质差异很大的原因是原子排列方式不同,他们的化学性质相似:稳定性、可燃性、还原性。活性炭有吸附性因为疏松多孔。
木炭还原氧化铜 \(C+2CuO\xlongequal{高温} 2Cu+CO_2\uparrow\),黑色粉末逐渐变为红色,澄清石灰水变浑浊,酒精加网罩:火焰集中:提高温度,反应结束后先将导管从石灰水中撤出、再熄灭酒精灯:防止石灰水倒吸入灼热的试管中使得试管破裂,待试管冷却后再把粉末倒出:防止热的 \(Cu\) 重新被氧化成 \(CuO\)。
碳跟二氧化碳 \(C+CO_2\xlongequal {高温}2CO\),炼铁高炉中提供还原剂。
一氧化碳还原氧化铁 \(3CO+Fe_2O_3\xlongequal{高温}2Fe+3CO_2\),操作步骤 \(检查装置气密性\to 装入药品\to 通入 CO 片刻后点燃酒精灯\to 点燃酒精喷灯 \to 熄灭酒精喷灯\)\(\to 熄灭酒精灯\to 玻璃管冷却后停止通入 CO\),试管中的固体粉末由红棕色逐渐变为黑色,澄清石灰水变浑浊,导管后尾气燃烧并产生蓝色火焰。
工业高炉炼铁:焦炭燃烧提供热量 \(C+O_2\xlongequal{高温}CO_2\),制取还原剂 \(CO_2+C\xlongequal{高温}2CO\),还原铁 \(3CO+Fe_2O_3\xlongequal{高温}2Fe+3CO_2\),其中石灰石的作用是把二氧化硅转变为炉渣。
一氧化碳还原氧化铁注意事项,先通入 \(CO\) 再点燃酒精灯:防止不纯气体加热爆炸,反应结束熄灭酒精灯后继续通入 \(CO\),防止高温的 \(Fe\) 重新被氧化。(一氧化碳早出晚归,酒精喷灯迟到早退)
\(NaOH\),常温下是易溶于水的白色固体,溶水放热,碱性,固态的有吸水性会潮解(物理变化),能干燥碱性/中和气体(跟酸性气体反应 \(2NaOH+CO_2\to Na_2CO_3+H_2O\)),可以去除油污、作为化工原料,具有强腐蚀性,不小心沾上先冲洗再涂上硼酸溶液(弱酸)。
溶解成溶液:一种或多种物质(溶质,被溶解)分散到另一种物质(溶剂,溶解其它物质,如水、汽油、酒精)里,生成均一、稳定的混合物。
碘几乎不溶于水但是可以溶解在汽油中,高锰酸钾几乎不溶于汽油但是可以溶解在水中,同一种物质在不同溶剂中的溶解性不同,不同的物质在同一溶剂中的溶解性也不同。
溶质可以是固体、液体、气体,液体相互溶解称量多的是溶剂,量少的是溶质,特别的如果其中一种是水那么水是溶剂,溶解中常伴随热量变化,吸热 \(NH_4NO_3\),放热 \(NaOH,H_2CO_3\),温度变化不明显 \(NaCl\)。溶解可以是物理变化也可以是化学变化。
乳化:一种液体以极微小液滴均匀地分散在互不相溶的另一种液体中的现象,所形成的乳浊液稳定性增强。
悬浊液:固液混合,一段时间后小颗粒沉降。
饱和溶液:在一定温度下,向一定量溶剂中加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液,否则叫做这种溶质的非饱和溶液。
增加溶剂或者升高温度(\(NaCl\) 变化不明显,\(Ca(OH)_2\) 温度越高溶解度越低)或升高压强(气体溶质)可以使饱和溶液变得不饱和,蒸发溶剂或者降低温度可以使不饱和溶液变得饱和,这个过程中过多的溶质会以晶体形式析出,结晶:降温结晶/蒸发结晶。
溶解度:一定量溶剂在溶质中溶解的限度,固体的溶解度表示一定温度下某固态物质在 \(100g\) 溶剂(不指明默认水)里达到饱和状态是所溶解的质量(带重量单位),气体的溶解度用体积表示,指该气体的压强为 \(101kPa\) 和一定温度时在单位体积水中溶解到饱和状态的气体体积。
溶液的浓度:\(溶质的质量分数\omega=\frac{溶质质量(只算溶解的)}{溶质质量}\times 100\%\)。
溶液配置的误差:首先每一种都有一个没有平视读数,\(\omega\) 偏小,溶质偏少:药品含有杂质、发生潮解 / 药品砝码位置放反并且使用游码 / 药瓶倒入烧杯有洒落、粘粘、溅出 / 溶质未完全溶解,溶剂偏多:烧杯试剂瓶中有水。\(\omega\) 偏大,溶质偏多:砝码生锈、有污渍,溶剂偏少:溶剂溅出。
合金:在金属中加热熔合某些金属或非金属制得的具有金属特征的混合物,一般硬度更大、熔点更低、抗腐蚀性更好。
钛合金:熔点高、密度小、可塑性好,与人体有很好的相容性,可以用来人造情感做人造骨。
铝抗氧化:\(4Al+3O_2\xlongequal{}2Al_2O_3\),表面形成一层致密的氧化膜。
金属材料:纯金属,合金。
有机合成材料:塑料,合成橡胶,合成纤维。
天然有机高分子材料:天然橡胶,天然纤维。
复合材料:玻璃钢,碳纤维复合材料,钢筋混凝土。
无机非金属材料:玻璃、陶瓷。
常见金属活动性顺序 \(K>Ca>Na>Mg>Al>Zn>Fe>H>Cu>Ag\)。
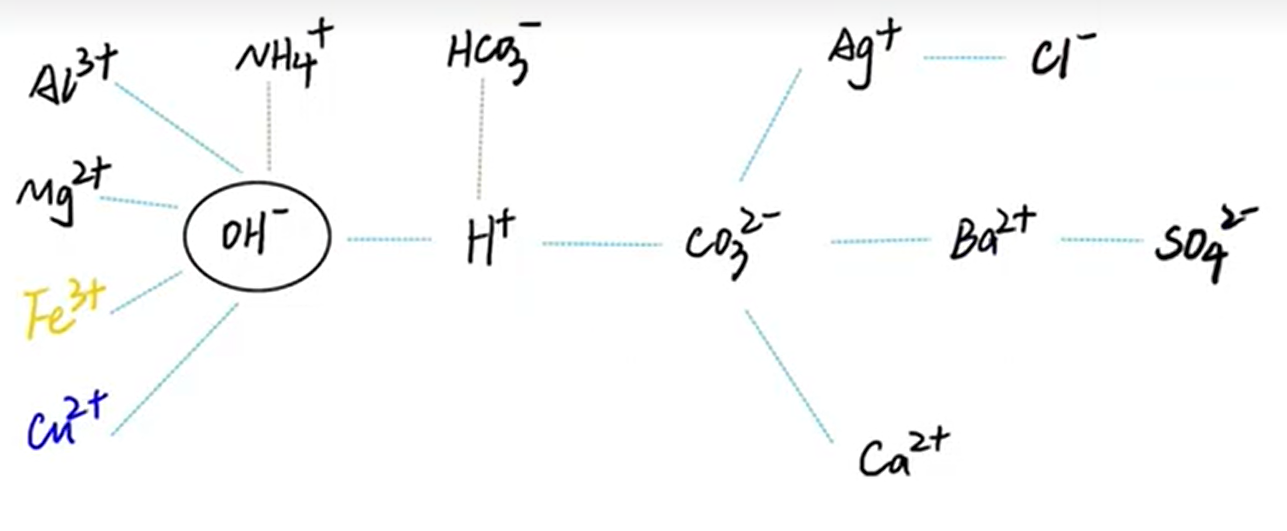

一般而言复分解生成 气体/沉淀/水。反应物有酸另一种不可溶于水,反应物没有酸两种都应该溶于水。
加纳氨硝皆可溶,盐酸盐中银不溶,硫酸盐不溶钡和铅,碳酸盐只溶钾钠铵,多数酸溶碱少溶,只有钾钠铵钡溶。
氢前金属与酸反应:\(金属+酸\to 盐+H_2\uparrow\)。
\(K,Ca,Na\) 太活泼会直接与水反应,一般是没有的。
\(Mg+2HCl\xlongequal{}MgCl_2+H_2\uparrow,Mg+H_2SO_4\xlongequal{}MgSO_4+H_2\uparrow\),反应非常剧烈,有大量气泡产生,放热。
\(2Al+6HCl\xlongequal{}2AlCl_3+3H_2\uparrow,2Al+3H_2SO_4\xlongequal{}Al_2(SO_4)_3+3H_2\uparrow\),反应剧烈,有大量气泡产生,放热。
\(Zn+2HCl\xlongequal{}ZnCl_2+H_2\uparrow,Zn+H_2SO_4\xlongequal{}ZnSO_4+H_2\uparrow\),反应比较剧烈,有较多气泡产生,放热。
\(Fe+2HCl\xlongequal{}FeCl_2+H_2\uparrow,Fe+H_2SO_4\xlongequal{}FeSO_4+H_2\uparrow\),反应较慢,有少量气泡产生,溶液由无色变浅绿色,放热。一般置换反应是 \(+2\) 价的铁,\(Fe_2O_3\) 加酸是 \(+3\) 价的铁。
酸与盐反应 \(金属+盐\to 盐+金属\)
铝与硫酸铜溶液 \(2Al+3CuSO_4\xlongequal{}Al_2(SO_4)_3+3Cu\),铝表面析出红色固体,溶液由蓝色变无色。
铁与硫酸溶溶液 \(Fe+CuSO_4\xlongequal{}FeSO_4+Cu\),铁表面析出红色固体,溶液由无色变浅绿色。
铜与硝酸银溶液 \(Cu+2AgNO_3\xlongequal{}Cu(NO_3)_2+2Ag\),铜表面析出银白色固体,溶液由无色变蓝色。
碳酸钠与稀盐酸 \(Na_2CO_3+2HCl\xlongequal{}2NaCl+H_2O+CO_2\uparrow\),碳酸钠与稀硫酸 \(Na_2CO_3+H_2SO_4\xlongequal{}NaSO_4+H_2O+CO_2\uparrow\),固体逐渐溶解,产生气泡。
酸与金属氧化物反应(复分解) \(金属氧化物+酸\to 盐+水\)
酸与氧化铁 \(Fe_2O_3+6HCl\xlongequal{}2FeCl_3+H_2O,Fe_2O_3+3H_SO_4\xlongequal{}CuSO_4+H_2O\),固体逐渐溶解,溶液变黄。
酸与氧化铜 \(CuO+2HCl\xlongequal{}CuCl_2+H_2O,CuO+H_2SO_4\xlongequal{}CuSO_4+H_2O\),固体逐渐溶解,溶液变蓝。
酸与碱反应(复分解) \(酸+碱\to 盐+水\),本质上是 \(H^+,OH^-\) 配对的过程。
酸与氢氧化钠 \(NaOH+HCl\xlongequal{}NaCl+H_2O,2NaOH+H_2SO_4\xlongequal{}Na_2SO_4+2H_2O\)。
酸与氢氧化钙 \(Ca(OH)_2+2HCl\xlongequal{}CaCl_2+2H_2O,Ca(OH)_2+H_2SO_4\xlongequal{}CaSO_4+2H_2O\)。
硝酸与碱 \(NaOH+HNO_3\xlongequal{}NaNO_3+H_2O,Ca(OH)_2+2HNO_3\xlongequal{}Ca(NO_3)_2+2H_2O\)。
碱与非金属氧化物 \(非金属氧化物+碱\to 盐+水\)
碱与二氧化碳 \(2NaOH+CO_2\xlongequal{}Na_2CO_3+H_2O,Ca(OH)_2+CO_2\xlongequal{}CaCO_3\downarrow+H_2O\),所以要密封保存。
碱与二氧化硫 \(2NaOH+SO_2\xlongequal{}Na_2SO_3+H_2O,Ca(OH)_2+SO_2\xlongequal{}CaSO_3\downarrow+H_2O\)。
碱与三氧化硫 \(2NaOH+SO_3\xlongequal{}Na_2SO_4+H_2O,Ca(OH)_2+SO_3\xlongequal{}CaSO_4+H_2O\)。
碱与盐 \(碱+盐\to 盐+碱\)
碱与硫酸铜 \(2NaOH+CuSO_4\xlongequal{}Cu(OH)_2\downarrow+Na_2SO_4,\) \(Ca(OH)_2+CuSO_4\xlongequal{}Cu(OH)_2\downarrow+CaSO_4\),产生蓝色沉淀。
金属与盐溶液反应,遵循优先反应原则:活动性差异越大的越优先。
溶液酸碱度的表示法 pH(范围 \(0\sim 14\)),排布 \(酸(0)中性(7)碱(14)\)。测定方法,在白瓷版或玻璃片上放一小块 pH 试纸,用玻璃棒蘸取待测液滴到 pH 试纸上,把试纸显示的颜色与标准比色卡比较。注意不能把 pH 试纸放入待测液中污染待测液,测定前试纸不能湿水(会稀释),测出的 pH 值是 \(0\sim 14\) 的整数。
氢氧化钠变质程度可以加酸碱盐来探究,首先变质原因是 \(2NaOH+CO_2\xlongequal{}H_2O+Na_2CO_3\),我们检测变不变质就是要检验里面的 \(Na_2CO_3\)。
滴加足量酸,\(NaCO_3+HCl\xlongequal{}NaCl+H_2O+CO+2\)(\(H_2SO_4\) 也行),产生气泡。
滴加碱,\(Na_2CO_3+Ca(OH)_2\xlongequal{}CaCO_3\downarrow+2NaOH\)(\(Ba(OH)_2\) 也行),产生白色沉淀。
滴加盐,\(Na_2CO_3+CaCl_2\xlongequal{}CaCO_3\downarrow+2NaCl\)(\(BaCl_2\) 也行),产生白色沉淀,加入足量盐后滴入酚酞可以检查是不是完全变质。
元素与人体健康。
缺钙:佝偻病、发育不良,老年人骨质疏松。
缺铁:血红蛋白的重要成分,贫血。
缺锌:食欲不振,生长缓慢,发育不良。
缺碘/碘过量:甲状腺肿大,思维迟钝。
缺氟:产生龋齿,氟过量:氟斑牙、氟骨病。
缺硒:缺硒可能引起表皮角质化和癌症,适量摄入可以防癌抗癌,过量使人中毒。
有机无机的辨别:点燃灼烧闻气味。
六大基本营养:糖类(碳水化合物)、脂肪、蛋白质、无机盐、水、维生素


 浙公网安备 33010602011771号
浙公网安备 33010602011771号