易基因:NC/IF15.7:WGBS+ATAC-seq+ChIP-seq等揭示DNA甲基化决定胚层细胞分化命运差异化响应的表观调控机制
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
近日,丹麦哥本哈根大学Elisabetta Ferretti团队以小鼠植入后外胚层(post-implantation epiblast)为模型,深入探究了细胞在响应相同分化信号(如WNT、BMP)时的不同命运(如神经外胚层、内胚层、中胚层)决定机制。研究利用外胚层干细胞(EpiSCs)体外培养模型,结合基因编辑、转录组测序、全基因组重亚硫酸盐测序(WGBS)、染色质免疫沉淀测序(ChIP-seq)和染色质可及性分析(ATAC-seq)等多组学技术,系统解析了表观遗传修饰如何决定外胚层细胞分化命运。相关研究成果以“Cell-context response to germ layer differentiation signals is predetermined by the epigenome in regionalized epiblast populations”发表在《Nature Communications》期刊。
研究发现,FGF/ERK信号通路活性在外胚层细胞中呈现梯度分布,通过调控DNA甲基化(而非染色质可及性)决定了神经外胚层、定型内胚层(Definitive Endoderm,DE)和神经中胚层祖细胞(NMPs)的命运偏倚,这种谱系偏倚在分化之前被“预编程”(primed)。DNA甲基化在WNT信号驱动下调控胚层分化,而染色质可及性则主要影响BMP信号介导的胚外中胚层(ExM)命运决定。研究进一步揭示转录因子PBX1通过调控ERK活性,进而影响ETS家族转录因子。PBX1-ERK-ETS轴不依赖于HOX功能,通过调控Spry2反馈回路,在外胚层期即构建谱系特异性表观基因组状态,从而决定细胞命运。

英文标题:Cell-context response to germ layer differentiation signals is predetermined by the epigenome in regionalized epiblast populations
中文标题:区域化外胚层细胞群中,细胞对胚层分化信号的差异化响应由表观基因组预先决定
发表时间:2025年5月29日
影响因子:IF15.7/Q1
技术平台:WGBS、ChIP-seq、ATAC-seq、scRNA-seq(易基因金牌技术)
作者单位:丹麦哥本哈根大学
DOI:10.1038/s41467-025-60348-6
干细胞凭借其分化为多种细胞类型的潜能,在再生医学领域展现出广阔前景。然而,干细胞维持多能性以及其向特定谱系进行命运特化的潜在分子机制仍未完全阐明。本研究利用体内外模型,发现谱系特异性表观遗传印记(染色质可及性和甲基化状态)先于胚层分化程序转录激活,且主要通过DNA甲基化影响神经外胚层、定型内胚层(DE)和神经中胚层谱系命运决定。总之,本研究证明表观遗传机制可精细调控外胚层多能性,使其能够对发育谱系进行时空特异性响应。
易基因相关拓展性产品案例
- 项目文章|Sci Adv:WGBS+ChIP-seq揭示DNA甲基化在异基因造血干细胞移植后延迟血小板恢复中的关键作用
- 项目文章|JAR (IF13):西农陈玉林团队多组学分析揭示绵羊早期胚胎发育的分子与表观遗传调控机制
- 项目文章 | 植入前胚胎的全基因组DNA甲基化和转录组分析揭示水牛胚胎基因组激活进展
- 项目文章|微量WGBS+ACE-seq揭示卵巢早衰的人卵丘细胞DNA甲基化与羟甲基化表观基因组图谱
研究方法
细胞模型:
使用小鼠外胚层干细胞(EpiSCs)作为植入后外胚层的体外模型。通过流式细胞术(FACS)分选出CLDN6High和CLDN6Low两个亚群进行研究。
遗传与药理学模型:
构建Pbx1基因敲除(KO)的EpiSCs细胞系,用于研究PBX1功能。
使用ERK通路抑制剂(PD0325901,PD03)处理细胞,模拟低ERK活性状态。
多组学综合分析:
- RNA-seq:分析CLDN6High/Low EpiSCs、Pbx1KO EpiSCs及其分化后细胞转录组差异。
- ATAC-seq:在全基因组范围内检测染色质开放区域,揭示染色质可及性状态差异。
- 全基因组甲基化测序(WGBS):在全基因组单碱基分辨率水平检测DNA甲基化(5mC)模式,揭示DNA甲基化如何预先决定细胞命运。
- ChIP-seq:在全基因组范围内鉴定PBX1蛋白的DNA结合位点,研究其直接调控的靶基因。
功能与表型分析:
- 免疫荧光(IF)与成像:对胚胎和细胞进行染色,观察谱系标记物表达和组织形态。
- 流式细胞术与分选:基于CLDN6表达进行细胞分选和表型分析。
- 电泳迁移率变动分析(EMSA):验证PBX1蛋白与Spry2基因调控区域的直接结合。
- 蛋白互作网络分析(STRING):构建并分析ERK/ETS与表观遗传调控蛋白之间的互作网络。
结果图形
(1)FGF/ERK信号谱系特征区分前部和远端后部外胚层
研究首先在E7.5小鼠胚胎中证实,紧密连接蛋白Cldn6表达呈现从前部到后部的梯度变化。利用这一特性,作者在EpiSCs中通过流式细胞术分选出CLDN6High和CLDN6Low两个亚群。转录组分析显示,CLDN6High细胞高表达上皮标志物(如Cdh1, Epcam)和FGF配体(Fgf4, Fgf5),而CLDN6Low细胞高表达间充质标志物(如Cdh2, Vim)和特定的ETS家族转录因子(Ets1, Etv1)。基因富集分析表明差异基因与ERK信号通路、细胞粘附和迁移相关。此外,流式检测显示CLDN6High细胞磷酸化ERK(pERK)水平更高。这些数据表明,CLDN6High和CLDN6Low EpiSCs分别模拟了体内前部(高ERK,上皮特征)和远端后部(低ERK,间充质特征)外胚层细胞的特性,且这种区域化特性与差异化ERK信号活性相关。
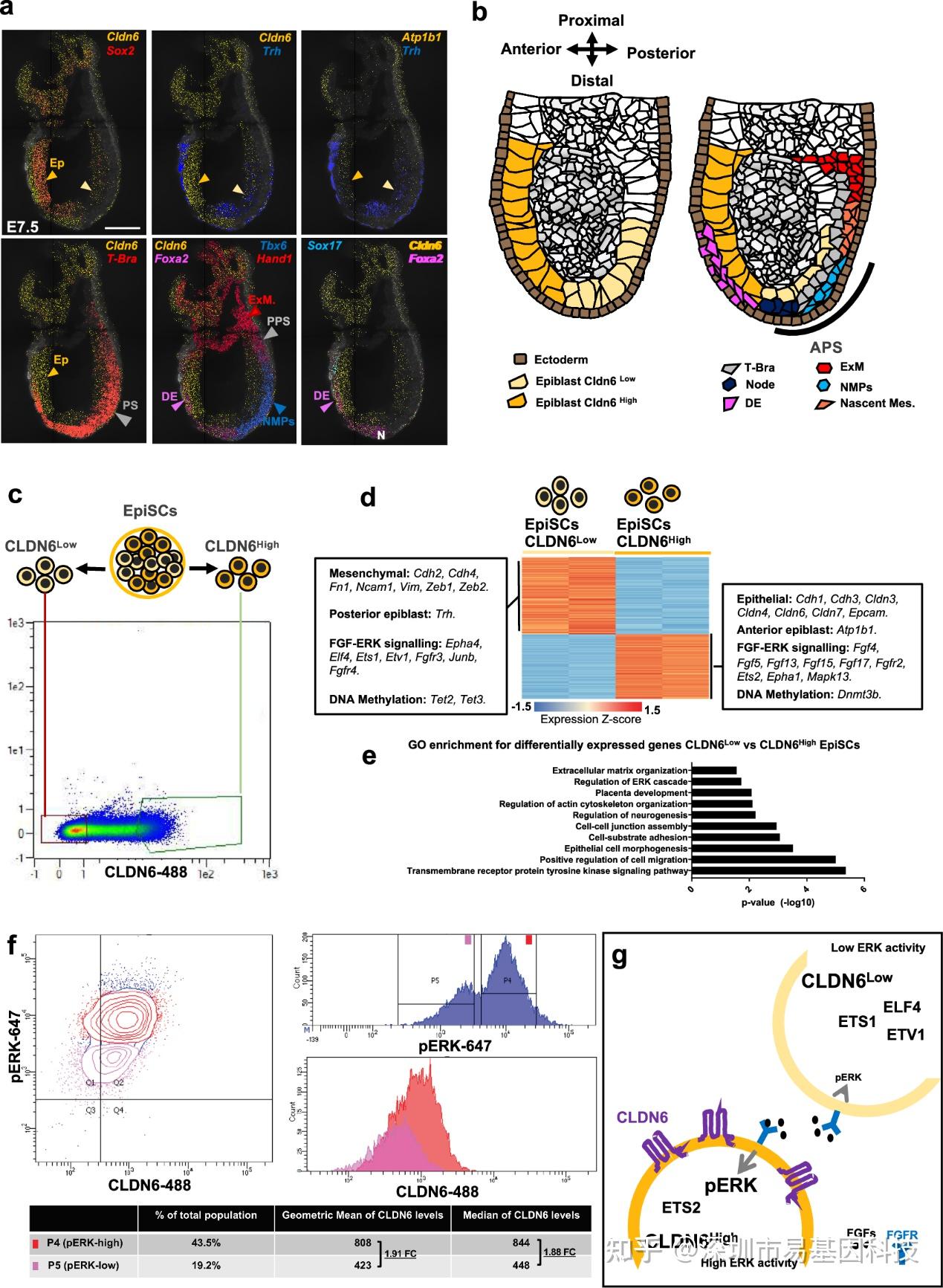
图1:具有前部和远端后部外胚层特性的区域化外胚层干细胞中的FGF/ERK差异性活性
(2)外胚层ERK信号水平预先决定胚层谱系命运
为验证ERK信号水平是否预先决定谱系命运,作者将分选的CLDN6High和CLDN6Low EpiSCs直接进行APSD分化。结果显示,CLDN6Low细胞(低ERK)能更高效分化为表达Tbx6和Msgn1的体节前中胚层(PSM),即中胚层/后部神经(脊髓)命运偏倚。而CLDN6High细胞(高ERK)则更偏向分化为表达Foxa2和Sox17的定形内胚层(DE)。在神经诱导条件下,只有CLDN6High细胞能成功分化为神经外胚层(形成神经元结构)。ERK抑制剂PD03处理野生型EpiSCs可以模拟低ERK状态并重现CLDN6Low细胞的谱系偏倚性(偏向PSM,抑制神经外胚层和DE)。上述功能实验强有力证明外胚层细胞内在的ERK信号水平差异,预先设定其对不同分化信号(WNT、BMP)的响应程序,从而决定最终胚层命运。
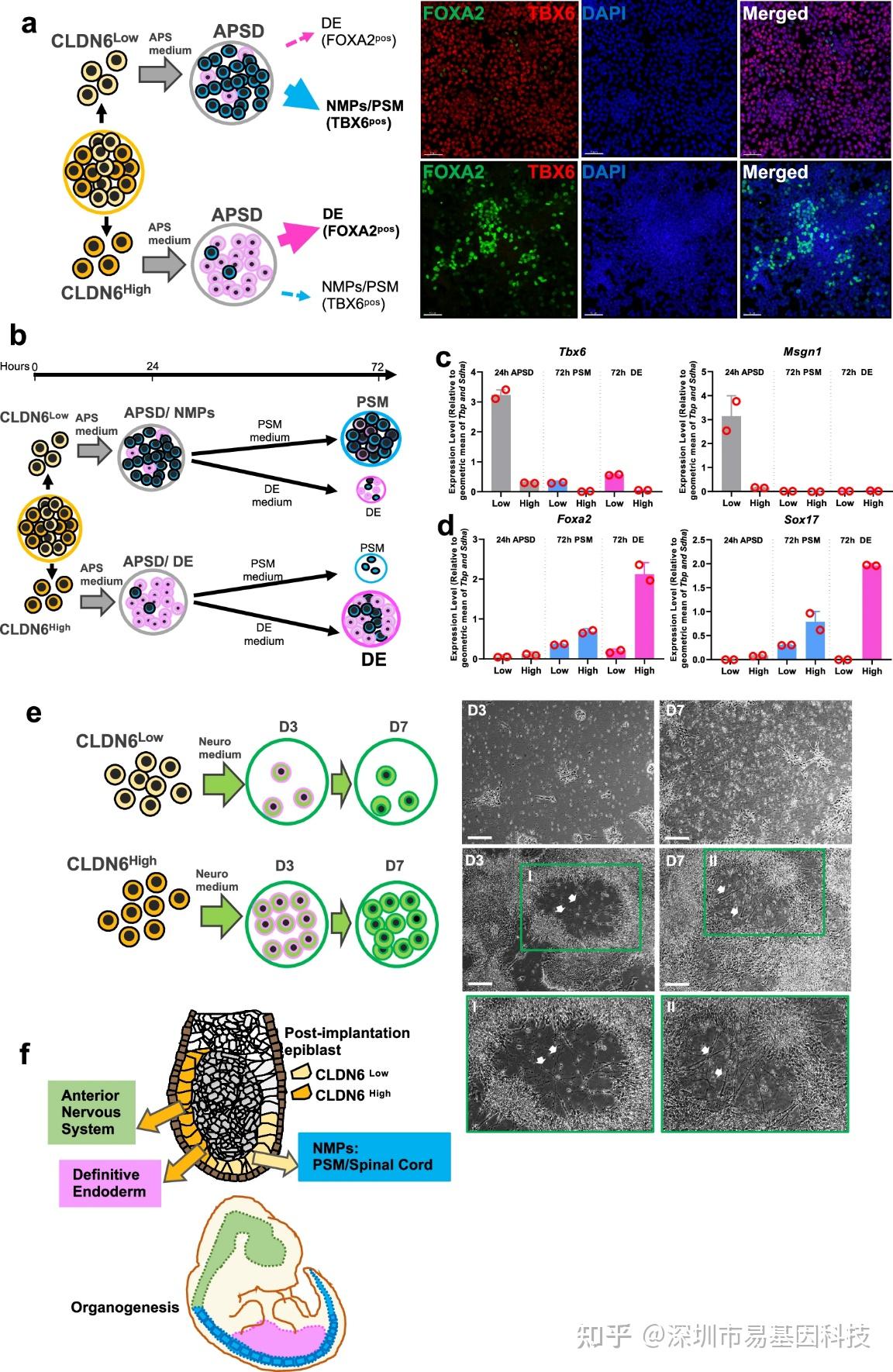
图2:CLDN6Low和CLDN6High外胚层干细胞具有显著胚层分化偏倚差异
(3)外胚层DNA甲基化预先决定WNT驱动的胚层命运
为探究表观遗传机制,研究者首先对CLDN6分选细胞进行ATAC-seq分析。出乎意料的是,在WNT抑制状态下,CLDN6High与CLDN6Low EpiSCs之间仅鉴定出110个差异可及性peaks(DAPs),且无任何DAPs与胚层谱系基因直接相关(图3a)。这一结果与之前报道的WNT信号驱动染色质异质性结论相悖,提示在EpiSCs维持条件下,染色质可及性并非命运偏向的主要决定因子。但WNT刺激后,CLDN6Low APSD中NMPs特异性顺式调控元件(CREs)可及性显著增加,伴随WNT效应因子LEF1结合增强(图3b),表明染色质重塑是WNT响应的下游事件而非预编程机制。
WGBS分析揭示决定性差异。尽管整体CpG甲基化水平无显著差异(~70%),CLDN6Low EpiSCs的内含子区域甲基化程度显著高于CLDN6High细胞(图3c-d)。更关键的是,差异甲基化基因(DMGs)分析发现,CLDN6Low与CLDN6High EpiSCs中,DE谱系基因(Foxa2, Gata6, Sox17)和神经外胚层基因(Pax6, Onecut1/2, Lmx1a, Dbx1)表现出高甲基化,而NMPs相关基因则无差异甲基化(图3e)。
以Pax6为例,其CRE区域在CLDN6High EpiSCs中特异低甲基化,与后续神经分化中Pax6表达上调相关(图3f),但ATAC-seq显示该CRE在两组EpiSCs中可及性类似,证明DNA甲基化状态先于染色质开放状态决定谱系功能。WNT诱导的CLDN6Low APSD分化伴随Pax6等区域甲基化水平下降(图3d),而CLDN6High APSD中DE基因甲基化状态保持稳定。
上述研究结果表明,DNA甲基化预先决定WNT响应机制,远端后部外胚层(CLDN6Low)通过高甲基化锁定DE和前神经命运,介导WNT信号驱动NMPs形成;而前部外胚层(CLDN6High)甲基化状态允许WNT诱导DE分化(图3g)。
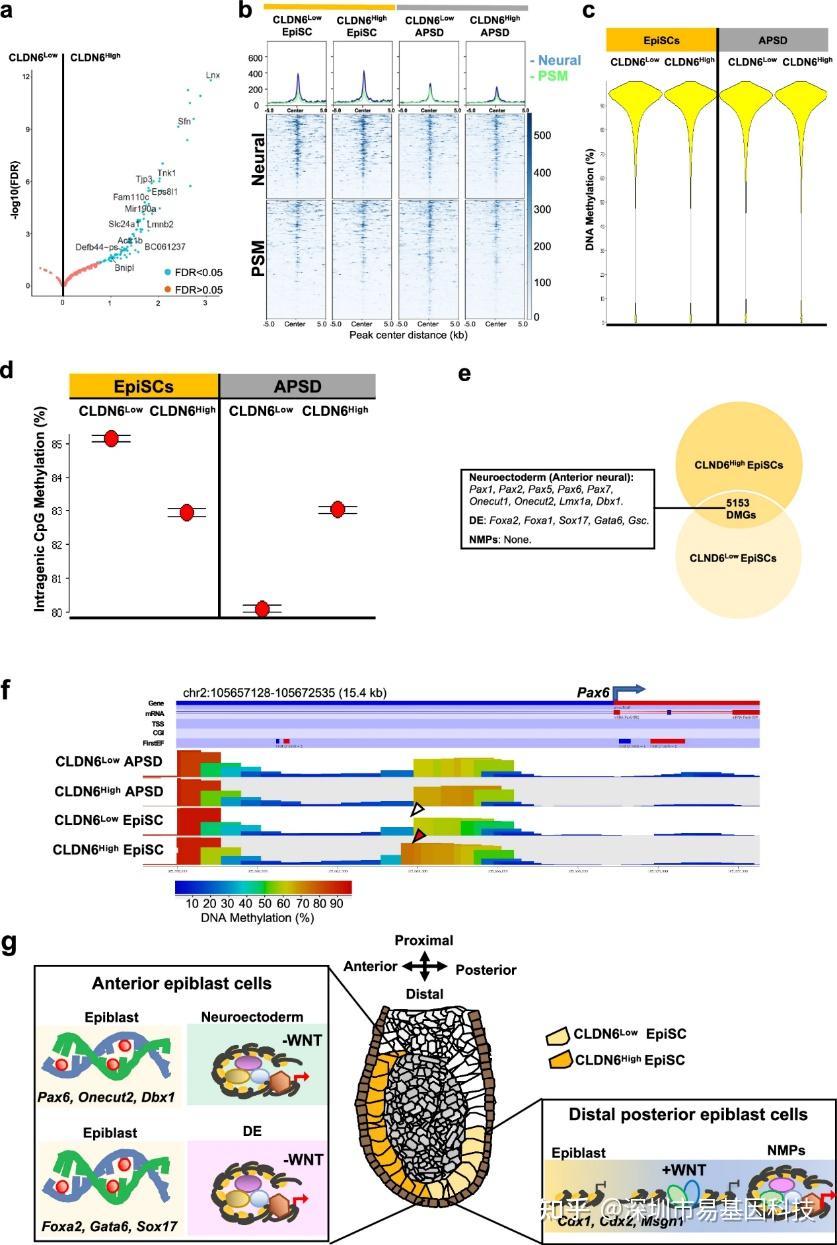
图3:外胚层甲基化组预先决定胚层分化过程中细胞的WNT响应
- ATAC-seq数据火山图显示与CLDN6Low外胚层干细胞相比,CLDN6High外胚层干细胞中有110个唯一差异可及性峰(DAPs)。
- CLDN6Low和CLDN6High外胚层干细胞及APSD在神经(前部和后部)与体节前中胚层(PSM)假定顺式调控元件(CREs)上的染色质可及性位点的平均密度图(上图)和热图(下图)。
- 豆荚图显示CLDN6Low和CLDN6High外胚层干细胞及APSD中基因±5 kb的CpG甲基化水平相似。
- 星战图显示内含子CpG甲基化水平,CLDN6Low外胚层干细胞中最高,CLDN6High APSD中最低。CLDN6High外胚层干细胞与APSD水平相似。
- 圆形代表CLDN6Low和CLDN6High外胚层干细胞各个细胞类型中的所有基因。重叠区域显示这两种细胞类型之间的差异甲基化基因(DMGs),包括高甲基化和低甲基化基因。CLDN6Low和CLDN6High外胚层干细胞具有与定型内胚层DE(Foxa2, Sox17, Gsc, Gata6)、神经外胚层(Pax6, Onecut1, Onecut2, Lmx1a, Dbx1)谱系相关的DMGs,但无神经中胚层祖细胞NMPs相关基因。
- Pax6基因组区域的WGBS可视化显示CLDN6High外胚层干细胞中特异高甲基化区域(红色箭头),相较CLDN6Low外胚层干细胞(白色箭头),位置和功能与先前研究PAX6 CRE41相似。
- 模式图展示DNA甲基化如何预先设定植入后外胚层细胞对WNT依赖性和非依赖性谱系命运的响应。
(4)PBX转录因子调控外胚层ERK水平和表观遗传机制
鉴于ERK信号对DNA甲基化的调控作用,研究者转向探索上游调控机制。PBX1作为TALE同源域蛋白,在E5.5外胚层中特异性表达(图4a)。Pbx1敲除EpiSCs(Pbx1KO)转录组显示1,018个差异表达基因,其中FGF配体(Fgf8)、ETS因子(Ets1, Etv1)和ERK拮抗剂(Spry2)显著上调,提示FGF/ERK信号失衡(图4b)。免疫印迹证实Pbx1KO细胞pERK水平降低而总ERK不变(图4c),且PD03处理可模拟CLDN6Low表型,确立了PBX1-ERK-CLDN6调控轴。
多组学整合分析显示,Pbx1KO导致576个DAPs,显著富集于BMP响应基因(Hand1, Tbx3等)和ETS结合基序(图4d-f)。WGBS进一步揭示,WT vs Pbx1KO EpiSCs中,BMP响应的胚外中胚层基因呈现差异甲基化(图4g)。ChIP-seq鉴定PBX1直接结合于Spry2调控区的两个CREs,其中p2位点为外胚层特异性可及区域。STRING分析构建的蛋白互作网络显示,ETS蛋白(Spi1/PU.1, ETV2)与DNMT3a/b、TET1/2/3等DNA甲基化/去甲基化酶在cluster 2中直接互作(图4h),表明ERK下游ETS因子直接招募至谱系位点的表观遗传机制。上述研究结果表明PBX1通过抑制Spry2负反馈回路维持ERK活性,进而经ETS因子编程外胚层特异性甲基化状态(图4i)。
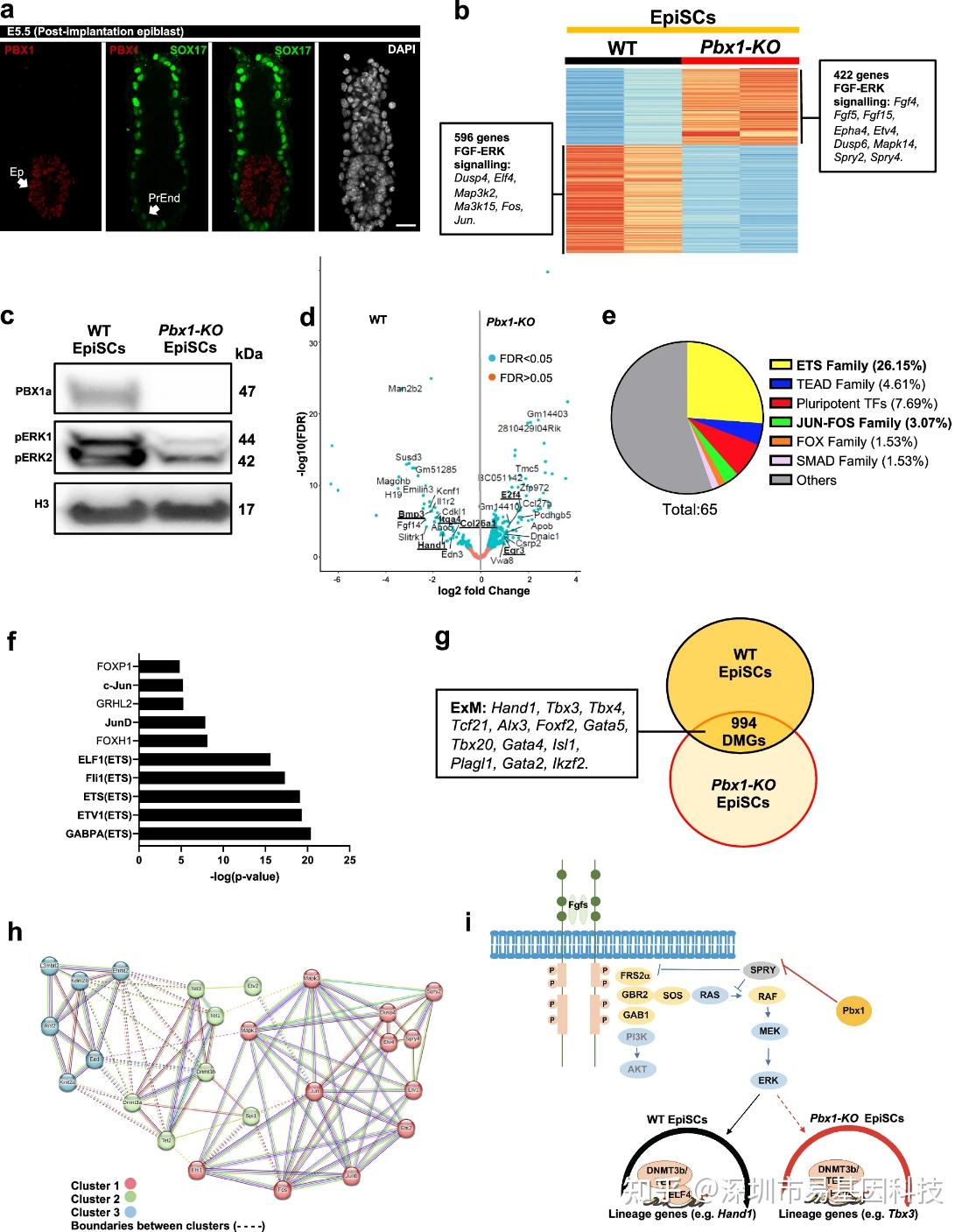
图4:PBX1调控外胚层干细胞中的ERK水平与表观遗传机制。
- 对植入后E5.5胚胎进行的共聚焦免疫荧光分析,显示PBX1在外胚层(Ep)中表达,而在原始内胚层(PrEnd)中不表达。
- 野生型(WT)与Pbx1敲除(Pbx1KO)外胚层干细胞中差异表达基因的热图,揭示了FGF/ERK信号通路组分的差异。
- Western blot证实PBX1敲除外胚层干细胞中PBX1缺失和磷酸化ERK1/2(pERK1/2)水平降低。
- 染色质可及性数据火山图显示Pbx1敲除外胚层干细胞中的576个差异可及性峰(DAPs),并显示BMP响应基因(Hand1, E2f4, Col26a1, Bmp3, Egr3, Itga4)富集。
- 野生型与Pbx1敲除外胚层干细胞input DAPs的de novo motif分析饼图,揭示ETS结合位点富集。
- 野生型相对于Pbx1敲除外胚层干细胞的576个DAPs富集ETS转录因子motif。
- 各细胞类型(野生型和Pbx1敲除型)圆圈图。重叠区域对应差异甲基化基因(DMGs)。
- STRING蛋白-蛋白互作网络分析显示ERK/ETS蛋白与表观遗传机制之间的互作。
- PBX1负调控ERK反馈环路从而调节ERK信号活性机制示意图。
(5)PBX/ERK信号预编程后部外胚层BMP响应以决定胚外中胚层命运
鉴于ExM命运由近端后部外胚层响应BMP信号产生,研究者利用Pbx1KO模型探究其调控机制。E7.5 Pbx1/2双敲胚胎显示HAND1+胚外中胚层严重缺陷(图5b)。体外分化实验重现该表型,Pbx1KO EpiSCs经BMP诱导后,尿囊/内皮标志物(Hand1, Kdr)表达下降,而卵黄囊/原始红细胞基因(Tbx3, Gata2, Tal1)上调(图5c-e),表明PBX/ERK活性缺乏使ExM命运偏向卵黄囊/红系而非尿囊/内皮。
WGBS与ATAC-seq联合揭示PBX/ERK预先设定BMP响应基因的表观状态。在WT EpiSCs中,尿囊标志物Hand1启动子呈低甲基化且染色质开放(图5g-h),为BMP诱导做好准备;而在Pbx1KO中,Hand1发生高甲基化且启动子关闭,导致表达缺失。但卵黄囊基因Tbx3在WT中因高甲基化而沉默,在Pbx1KO中去甲基化并开放染色质(图5i-j),从而在分化中优势表达。差异甲基化与差异可及性在EpiSC期就已构建,远早于BMP诱导的转录激活(图5f)。这证明PBX/ERK通过调控甲基化+染色质状态的表观遗传印记,促进区域化外胚层对同一BMP信号产生差异ExM命运决定。
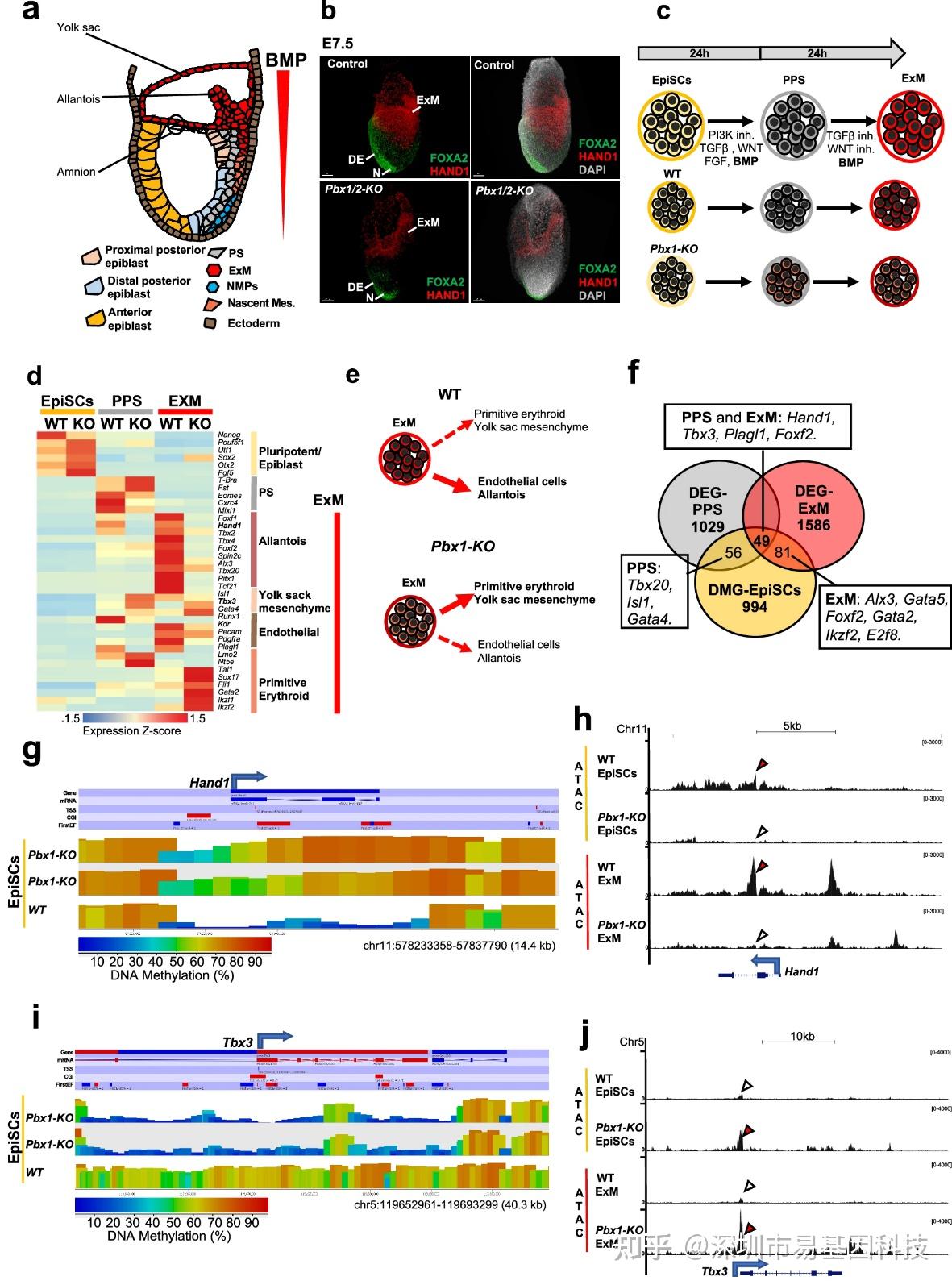
图5:ERK缺失型Pbx1敲除外胚层干细胞在分化相关的胚外中胚层缺失出现前,已在胚外中胚层谱系基因上表现出特异性染色质和DNA甲基化谱。
- 受BMP信号影响的E7.5时期胚外中胚层谱系:尿囊、羊膜和卵黄囊。
- E7.5对照组和Pbx1f/f;Pbx2;Sox2-/-Cre/+胚胎的共聚焦三维投影图。
- 野生型和Pbx1敲除外胚层干细胞向PPS和ExM细胞分化实验方案示意图。
- 不同阶段(黄色:外胚层干细胞,灰色:PPS,红色:ExM)的谱系特异性差异表达基因(DEDG)热图。
- Pbx1敲除外胚层干细胞在进行胚外中胚层分化时,表现出向原始红细胞和卵黄囊间充质分化偏好。
- 野生型与Pbx1敲除外胚层干细胞中的差异甲基化基因(DMGs)及其在PPS和ExM分化过程中的转录变化示意图。
- WGBS可视化图,显示野生型和Pbx1敲除外胚层干细胞中Hand1位点差异甲基化区域,表明Pbx1敲除细胞中存在高甲基化。条形图显示CpG甲基化水平。
- Hand1位点的UCSC基因组浏览器视图,显示在野生型条件下染色质可及性增加,而在Pbx1敲除细胞中该位点保持关闭状态。
- WGBS轨迹图,显示野生型和Pbx1敲除外胚层干细胞中Tbx3位点的CpG甲基化水平,表明野生型外胚层干细胞中存在高甲基化。底部条形图描绘CpG甲基化水平。
- Tbx3位点ATAC-seq轨迹图显示Pbx1敲除细胞与野生型细胞相比,染色质可及性增加。
结论和启示
本研究通过多组学联合分析,首次明确了DNA甲基化与染色质可及性在胚层分化命运中的时序与功能分工。传统观念认为WNT信号直接驱动染色质重塑产生命运偏向,但本研究利用EpiSCs的WNT抑制培养条件,结合ATAC-seq与WGBS的时空数据,证明DNA甲基化是WNT响应的上游决定因子,而染色质开放是WNT激活后的执行步骤。研究确立了ERK信号剂量依赖性表观遗传预编程作为区域化外胚层响应分化信号的核心机制。
WGBS、ChIP-seq与ATAC-seq的协同应用在本研究中的重要作用
WGBS:直接揭示了CLDN6High和CLDN6Low细胞在未分化状态下就已存在的、谱系特异性的DNA甲基化差异。这些甲基化差异是预先决定细胞对WNT信号差异化响应的主要表观遗传屏障,其作用先于并独立于染色质可及性的变化。
ATAC-seq:在本研究中起到重要的对比和补充作用。研究发现,在谱系决定的关键阶段,CLDN6High和CLDN6Low细胞间的染色质可及性差异很小,提示DNA甲基化是更早的、主导性的预编程因子。而在Pbx1KO模型中,ATAC-seq则与WGBS结果相互印证,共同揭示了ExM谱系基因位点可及性与甲基化状态的协同变化。
ChIP-seq:通过PBX1的ChIP-seq,研究者直接找到了其下游靶基因Spry2,将PBX1与ERK信号通路的调控直接联系起来,为上游调控机制提供确凿证据。
关于易基因全基因组重亚硫酸盐测序(WGBS)
全基因组重亚硫酸盐甲基化测序(WGBS)可以在全基因组范围内精确的检测所有单个胞嘧啶碱基(C碱基)的甲基化水平,是DNA甲基化研究的金标准。WGBS能为基因组DNA甲基化时空特异性修饰的研究提供重要技术支持,能广泛应用在个体发育、衰老和疾病等生命过程的机制研究中,也是各物种甲基化图谱研究的首选方法。
易基因全基因组甲基化测序技术通过T4-DNA连接酶,在超声波打断基因组DNA片段的两端连接接头序列,连接产物通过重亚硫酸盐处理将未甲基化修饰的胞嘧啶C转变为尿嘧啶U,进而通过接头序列介导的 PCR 技术将尿嘧啶U转变为胸腺嘧啶T。
应用方向:
WGBS广泛用于各种物种,要求全基因组扫描(不错过关键位点)
- 全基因组甲基化图谱课题
- 标志物筛选课题
- 小规模研究课题
技术优势:
- 应用范围广:适用于所有参考基因组已知物种的甲基化研究;
- 全基因组覆盖:最大限度地获取完整的全基因组甲基化信息,精确绘制甲基化图谱;
- 单碱基分辨率:可精确分析每一个C碱基的甲基化状态。
关于易基因染色质免疫共沉淀测序 (ChIP-seq)
染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP),是研究体内蛋白质与DNA相互作用的经典方法。将ChIP与高通量测序技术相结合的ChIP-Seq技术,可在全基因组范围对特定蛋白的DNA结合位点进行高效而准确的筛选与鉴定,为研究的深入开展打下基础。
DNA与蛋白质的相互作用与基因的转录、染色质的空间构型和构象密切相关。运用组蛋白特定修饰的特异性抗体或DNA结合蛋白或转录因子特异性抗体富集与其结合的DNA片段,并进行纯化和文库构建,然后进行高通量测序,通过将获得的数据与参考基因组精确比对,研究人员可获得全基因组范围内某种修饰类型的特定组蛋白或转录因子与基因组DNA序列之间的关系,也可对多个样品进行差异比较。
应用方向:
ChIP 用来在空间上和时间上不同蛋白沿基因或基因组定位
- 转录因子和辅因子结合作用
- 复制因子和 DNA 修复蛋白
- 组蛋白修饰和变异组蛋白
技术优势:
- 物种范围广:细胞、动物组织、植物组织、细菌微生物多物种富集经验;
- 微量建库:只需5ng以上免疫沉淀后的DNA,即可展开测序分析;
- 方案灵活:根据不同的项目需求,选择不同的组蛋白修饰特异性抗体。
技术路线:
易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化、cfDNA)和表观转录组学(m6A、m5C、m1A、m7G、ac4C、RNA与蛋白互作)、DNA与蛋白互作及染色质开放性技术方案(ChIP-seq、ATAC-seq),更多表观组学或多组学研究可关注易基因公众号、网站、市场微信号等,期待与各位老师开展合作交流。
参考文献:
Menezes NA, Peterson KJ, Guo X, Castiglioni V, Kalvisa A, Filimonow K, Schachter K, Schuh CM, Pasias A, Mariani L, Brickman JM, Sedzinski J, Ferretti E. Cell-context response to germ layer differentiation signals is predetermined by the epigenome in regionalized epiblast populations. Nat Commun. 2025 May 29;16(1):5000. doi: 10.1038/s41467-025-60348-6.
相关阅读:
1.项目文章|Sci Adv:WGBS+ChIP-seq揭示DNA甲基化在异基因造血干细胞移植后延迟血小板恢复中的关键作用
2.项目文章|JAR (IF13):西农陈玉林团队多组学分析揭示绵羊早期胚胎发育的分子与表观遗传调控机制
3.项目文章 | 植入前胚胎的全基因组DNA甲基化和转录组分析揭示水牛胚胎基因组激活进展
4.项目文章|微量WGBS+ACE-seq揭示卵巢早衰的人卵丘细胞DNA甲基化与羟甲基化表观基因组图谱
5.项目集锦 | 易基因近期染色质免疫共沉淀测序(ChIP-seq)研究成果



 浙公网安备 33010602011771号
浙公网安备 33010602011771号