易基因:Sci Adv/IF12.5重磅发现:中山六院梁晓燕团队多组学揭示ac4C RNA修饰调控卵母细胞发育和妊娠结局的表观遗传机制
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
2025年7月18日,中山大学附属第六医院谢芸博士、周传传副研究员为共同第一作者,中山六院生殖医学中心学科带头人梁晓燕教授为唯一通讯作者,在国际知名学术期刊《Science Advances》上发表题为“Nicotinamide boosts oocyte quantity and quality by promoting N4-acetylation modification in lupus mice”的科研成果。研究系统揭示了N4-乙酰胞苷(ac4C) RNA修饰在系统性红斑狼疮(systemic lupus erythematosus,SLE)的卵母细胞发育障碍中的核心调控作用。
本研究通过整合临床数据分析、SLE小鼠模型构建及微量转录组-翻译组测序、微量细胞ac4C测序(acRIP-seq)等多组学分析,并结合功能验证实验,系统揭示了SLE导致卵母细胞数量减少和质量下降的核心分子机制:N-乙酰转移酶10(NAT10)介导的ac4C RNA修饰水平下调,进而损害了包括合子停滞蛋白1(Zygote arrest 1,Zar1)在内关键母源基因的翻译效率,最终导致卵母细胞发育障碍。更重要的是,研究发现补充维生素B3家族成员烟酰胺(Nicotinamide, NIA)能够通过抑制去乙酰化酶SIRT1,增强NAT10活性和ac4C修饰水平,从而安全有效地改善SLE小鼠的卵母细胞质量、数量、体外成熟率及妊娠结局,为SLE患者生育力保护提供了靶向RNA表观转录组的精准干预策略。

英文标题:Nicotinamide boosts oocyte quantity and quality by promoting N4-acetylation modification in lupus mice
中文标题:烟酰胺通过促进狼疮小鼠的ac4C修饰来提高卵母细胞的数量和质量
发表时间:2025-7-18
发表期刊:Science Advances
影响因子:IF12.5/Q1
技术平台:转录组-翻译组、微量ac4C(acRIP-seq)(易基因金牌技术)
作者单位:中山大学附属第六医院
系统性红斑狼疮(SLE)是一种常见于育龄期女性的自身免疫性疾病,患者常伴有生育能力下降,目前SLE对卵母细胞减数分裂和发育相关的基因翻译过程的影响尚不明确。
本研究首先进行转录组和翻译组测序技术发现SLE小鼠卵母细胞中的蛋白翻译存在显著紊乱,且与ac4C修饰相关。在体外抑制ac4C水平会显著降低卵母细胞的翻译效率。
接下来,研究人员通过微量ac4C RNA免疫沉淀测序(acRIP-seq),绘制了SLE小鼠卵母细胞的ac4C修饰图谱,并发现ac4C修饰缺失会严重损害Zar1的翻译效率。
此外,研究人员通过SLE小鼠功能验证实验发现,烟酰胺干预可以通过增强ac4C修饰水平,显著且安全地改善SLE小鼠卵母细胞的数量和质量。
本研究结果揭示了N-乙酰转移酶10(NAT10)介导的ac4C修饰在SLE卵母细胞异常发育中的关键作用,并提示了烟酰胺在改善SLE患者生育力方面具有应用前景。
易基因相关拓展性产品案例
- 易基因ac4C乙酰化RNA免疫沉淀测序(acRIP-seq)
- 新方向:RNA修饰N4-乙酰胞苷(ac4C)的调控机制、检测方法及其在癌症中的作用最新研究进展
- Adv Sci浙大范衡宇团队acRIP-seq揭示哺乳动物mRNA乙酰化修饰ac4C形成机制
- m6A/m5C/m1A/m7G/ac4C/Ψ等8种RNA修饰的生物学功能和潜在机制 | 深度综述
研究方法
- 临床回顾性队列研究:收集50名SLE女性和200名匹配对照的体外受精/卵胞质内单精子注射(IVF/ICSI)周期数据,比较了抗缪勒管激素(AMH)、窦卵泡计数(AFC)、获卵数、胚胎发育指标(可用胚胎率、卵母细胞利用率)及临床结局(早期流产率、活产率)。
2、SLE小鼠模型构建:对6周龄雌性C57BL/6小鼠耳部TLR7诱导产生SLE样表型(如肾炎、系统性炎症、脾肝肿大等)。
3、卵母细胞表型分析:数量评估(超数排卵后,计数GV期和MII期卵母细胞获取数量)、质量评估(线粒体功能、纺锤体形态、胚胎发育力)
4、微量细胞多组学测序与分析:
- T&T-seq(转录组与翻译组联合测序):分别收集SLE和野生型(WT)小鼠的GV期和MII期卵母细胞,同步进行转录组(总RNA)和翻译组(核糖体结合RNA)测序。通过计算翻译效率(TE,翻译组FPKM/转录组FPKM)来评估基因的翻译活性。
- 微量acRIP-seq:使用抗ac4C抗体对SLE小鼠GV期卵母细胞进行RNA免疫共沉淀,结合高通量测序,在全基因组范围内绘制ac4C修饰图谱,鉴定ac4C修饰靶基因。
5、分子机制验证:
- 免疫荧光染色:检测卵母细胞中ac4C、m6A、NAT10、ZAR1的蛋白水平及定位。
- qRT-PCR:验证Nat10、Zar1等基因的mRNA表达水平。
- 体外功能验证:使用NAT10抑制剂Remodelin处理卵母细胞,观察其对ac4C修饰、翻译效率及卵母细胞成熟的影响。
6、干预实验:
- 烟酰胺(NIA)处理:对SLE小鼠进行烟酰胺灌胃给药(100 mg/kg/天),评估其对卵母细胞ac4C修饰水平、数量、质量(线粒体膜电位、纺锤体形态)、体外成熟率及体内胚胎发育结局的改善作用。
- 安全性评估:观察NIA处理对SLE小鼠子代主要器官的组织学影响。
结果图形
(1)SLE女性卵巢功能下降导致不良出生结局
通过对临床数据进行分析,研究发现SLE女性患者血清AMH水平(图1A)和窦卵泡计数(AFC)(图1B)均显著降低,表明其卵巢储备功能受损。在辅助生殖治疗中,SLE患者获卵数也显著减少(图1C)。尽管正常受精率无统计学差异(图1D),但SLE组可用胚胎率(图1E)和卵母细胞利用率(图1F)显著降低,卵母细胞胞质成熟度与发育潜能受损。进而导致临床结局中SLE组早期流产率显著升高(图1G),活产率显著降低(图1H)。上述结果从临床层面证实SLE疾病状态损伤卵母细胞数量和质量导致女性生育力下降。
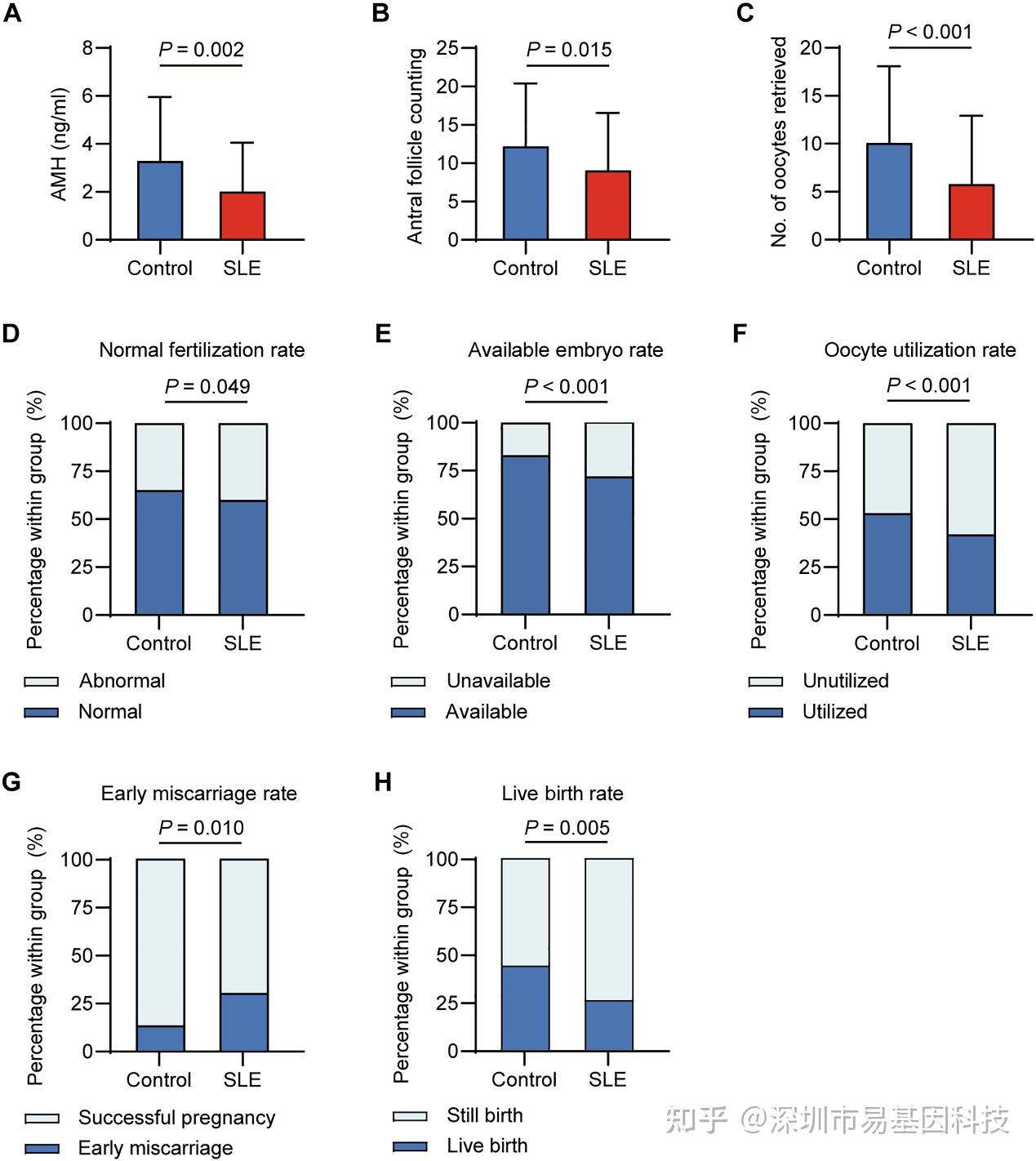
图1:SLE女性卵巢功能和卵母细胞质量下降
(2)SLE小鼠的卵母细胞损伤
为排除临床混杂因素,研究使用TLR7诱导的SLE小鼠模型,直接评估疾病对卵母细胞的功能影响。结果显示,SLE小鼠超排卵后获得的GV期和MII期卵母细胞数量均显著少于WT小鼠(图2A、D)。TMRM染色显示,SLE小鼠GV期和MII期卵母细胞的线粒体膜电位显著降低(图2B-C),提示能量代谢异常。
线粒体功能持续受损(图2E-F),纺锤体形态异常率升高(图2G-H),染色体排列紊乱。
IVF实验进一步证实,SLE小鼠MII期卵母细胞受精后,胚胎发育阻滞主要发生于4细胞期之后(图2I-J),表明母源-合子转换(MZT)障碍。上述结果成功模拟了SLE患者卵母细胞数量与质量双重受损的临床特征,为机制研究奠定了可靠的疾病模型基础。
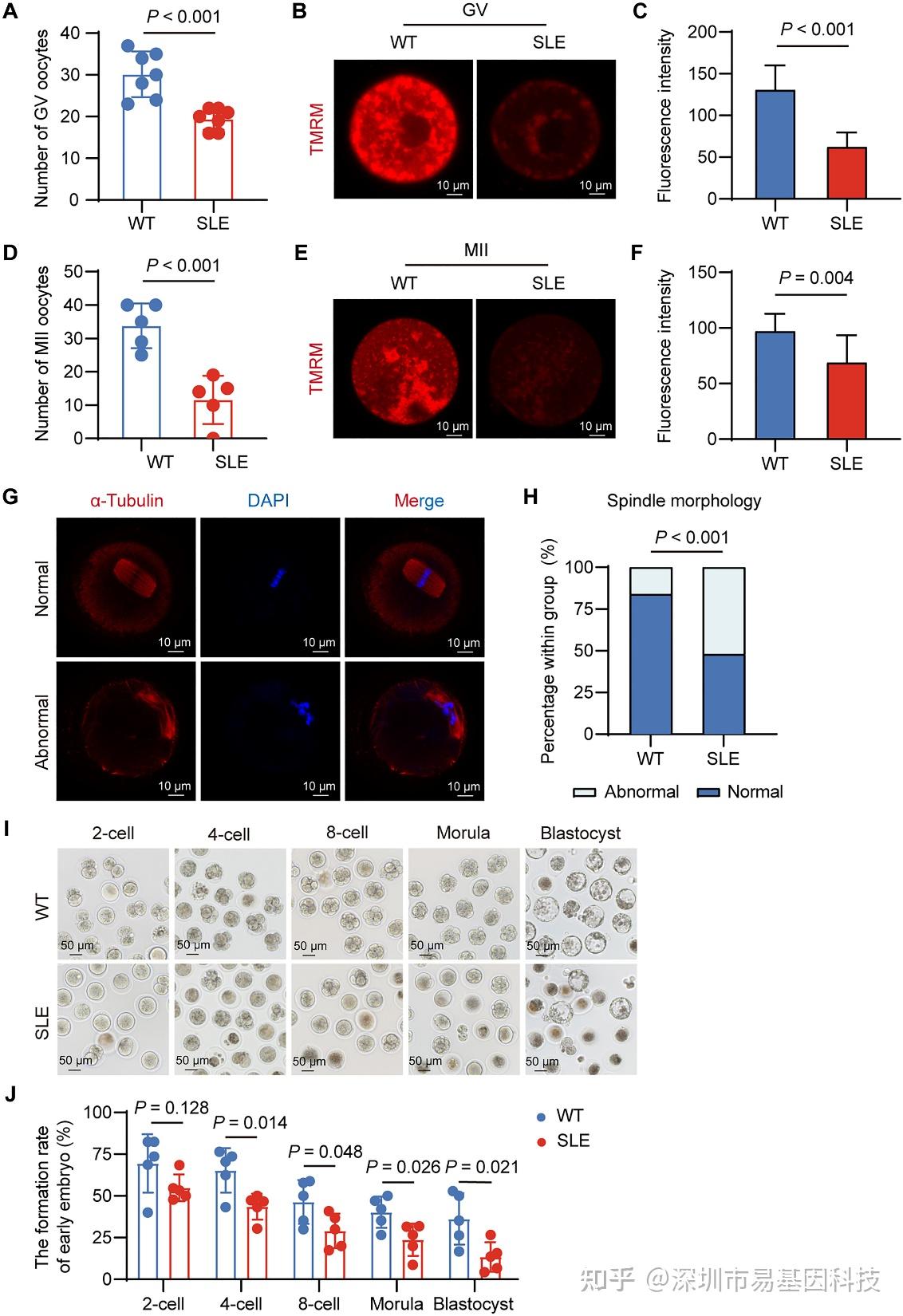
图2:SLE小鼠的卵母细胞损伤
(3)SLE小鼠卵母细胞基因表达异常主要发生在GV期的翻译过程
研究通过T&T-seq技术对SLE和WT小鼠卵母细胞的转录组和翻译组进行高通量分析。三维主成分分析(3D PCA)显示,SLE与WT卵母细胞在GV期的翻译组差异最显著(图3B-E)。火山图分析表明,差异表达基因(DEGs)数量远超转录组,而MII期差异程度减弱(图3F-I)。
翻译效率(TE)累积曲线和散点图显示,SLE小鼠GV期卵母细胞的整体翻译效率显著降低(图4A),多达6557个基因的TE下调(图4C)。KEGG富集分析发现,TE下调基因主要富集于代谢、自噬、细胞周期、DNA复制、蛋白质合成与降解、、线粒体自噬及细胞衰老等对卵母细胞发育至关重要的通路。
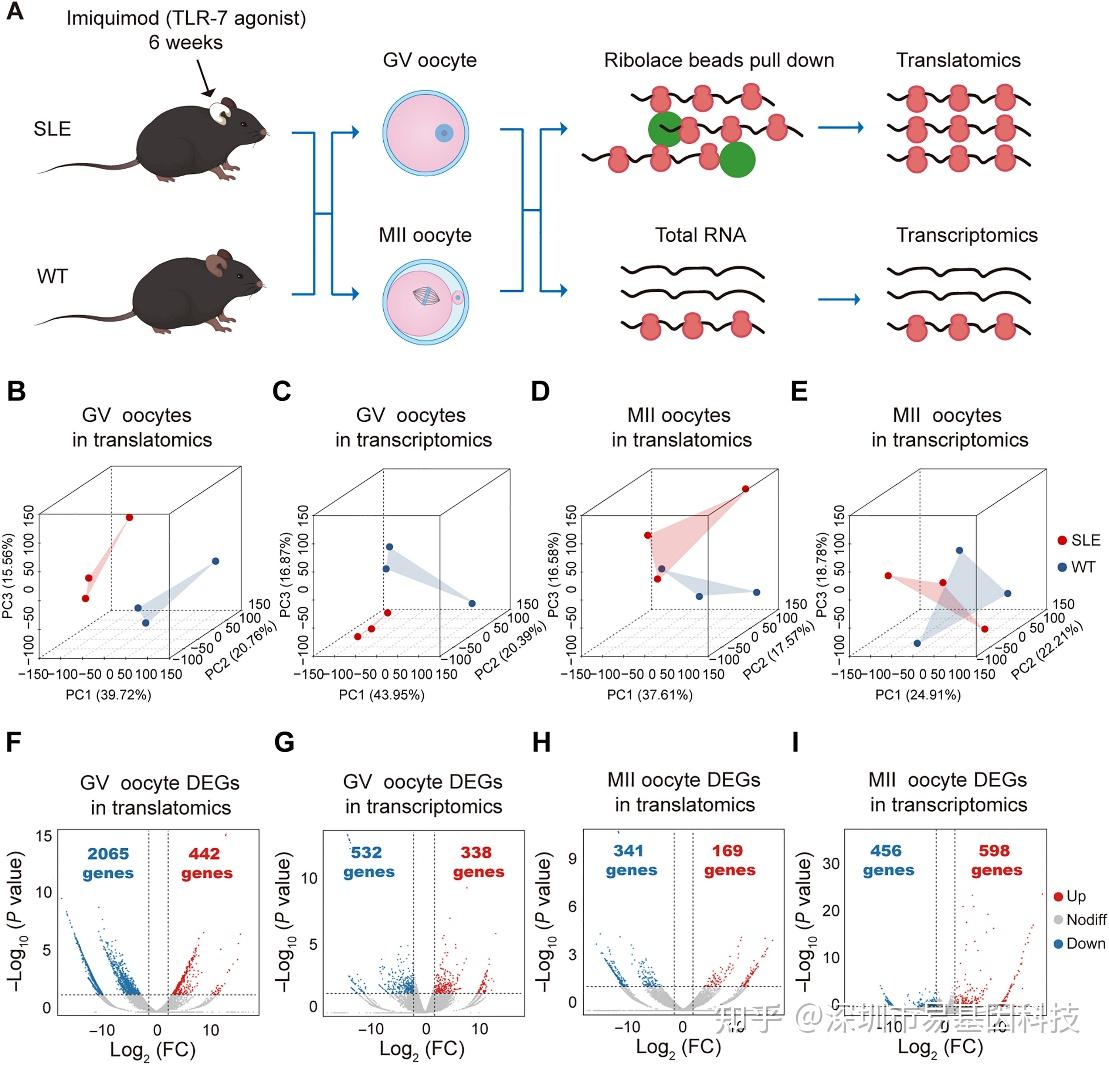
图3:SLE与WT小鼠GV期和MII期卵母细胞的转录组学与翻译组学特征差异
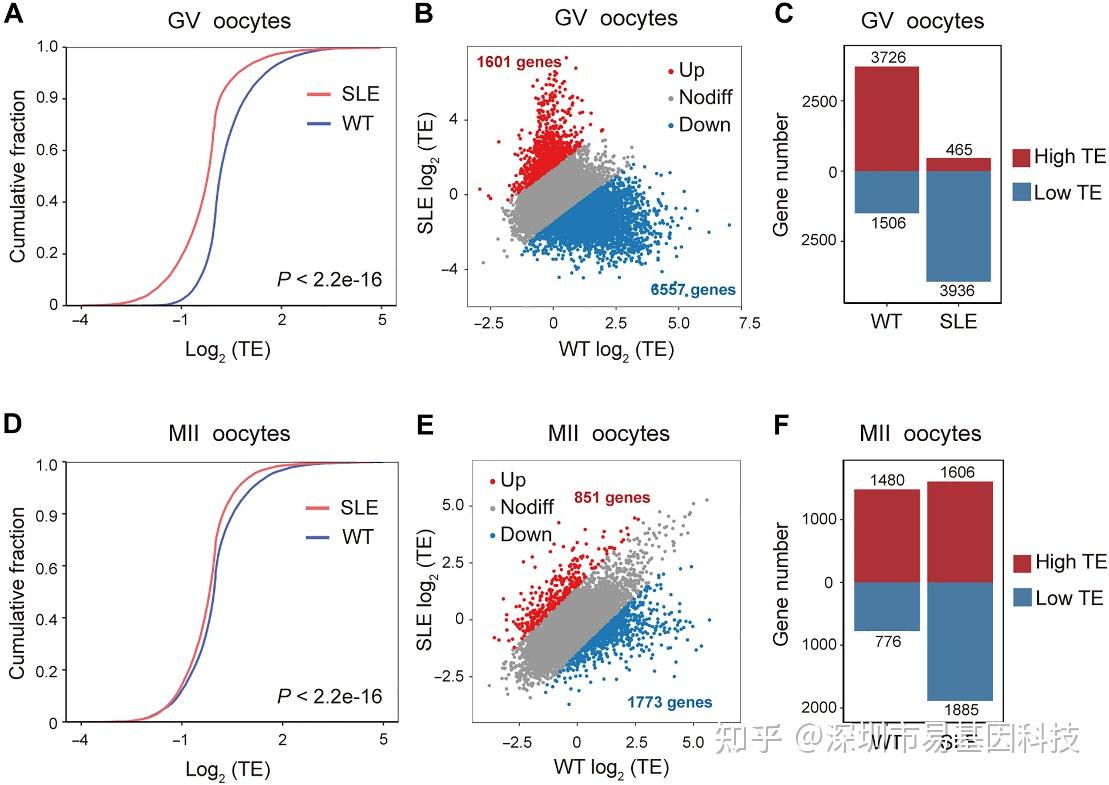
图4:SLE小鼠卵母细胞的翻译失调
(4)SLE小鼠卵母细胞翻译失调与NAT10介导的ac4C修饰相关
为解析翻译失调的表观转录机制,研究聚焦m6A与ac4C两大RNA修饰。将GV期卵母细胞基因按m6A/ac4C修饰状态进行分组分析,发现ac4C修饰基因的TE下降最显著(图5A)。免疫荧光证实,SLE小鼠GV期卵母细胞ac4C修饰水平显著低于WT(图5B-C),而m6A修饰无差异(图5E-F),组学数据分析进一步显示,ac4C修饰在WT小鼠中能增强基因TE,但在SLE小鼠中的增强效应显著减弱(图5D)。表明ac4C是SLE特异性翻译调控位点。
由于NAT10是催化ac4C修饰的唯一writer酶,研究检测了其表达。结果显示,SLE与WT小鼠卵母细胞中Nat10的转录水平无差异,但翻译水平和蛋白水平均显著下降(图5G-L)。这表明SLE通过下调NAT10翻译,导致其蛋白减少,进而引起ac4C修饰水平降低,是造成卵母细胞翻译失调的主要原因。
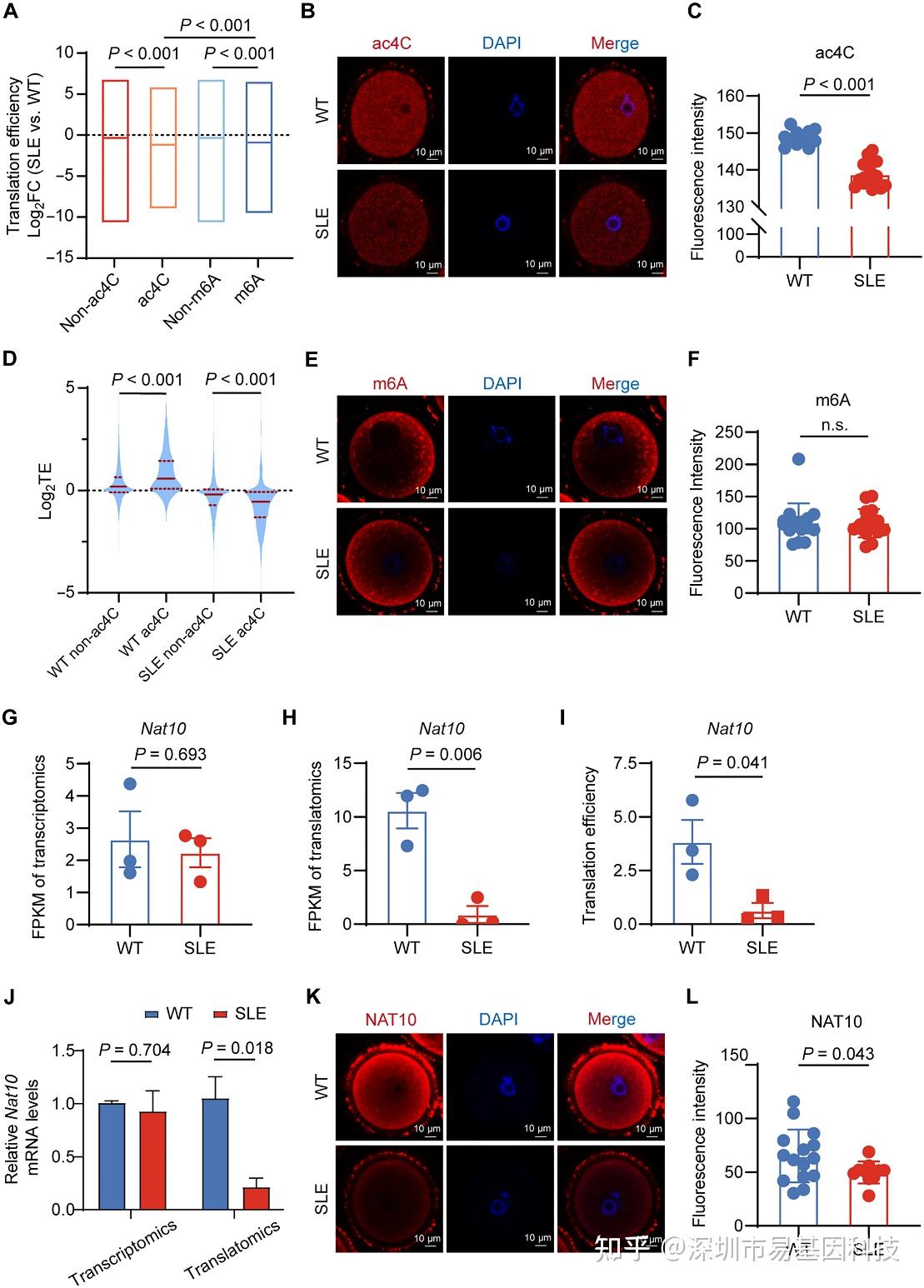
图5:NAT10介导的ac4C修饰对SLE小鼠GV期卵母细胞基因翻译的影响
(5)抑制ac4C降低卵母细胞翻译效率(TE),导致发育障碍
为验证ac4C修饰的功能,研究使用NAT10抑制剂Remodelin在体外处理卵母细胞,构建ac4C缺失模型(图6A-C)。功能表型显示,Remodelin处理组线粒体膜电位降低(图6D-E),纺锤体异常率升高,体外成熟率下降(图6F-H),完美构建SLE卵母细胞损伤表型。
T&T-seq分析显示,Remodelin处理组卵母细胞的翻译组变化模式与SLE卵母细胞相似,翻译组差异基因(645下调/278上调)显著多于转录组(382下调/183上调)(图6I-J),TE累积曲线右移(图6K),TE下调基因远多于上调基因(图6L),低TE基因数量增加(646 vs 220)、高TE基因减少(1516 vs 2210)(图6M)。上述功能缺失验证实验结果建立了ac4C -NAT10轴与发育表型的直接因果链。
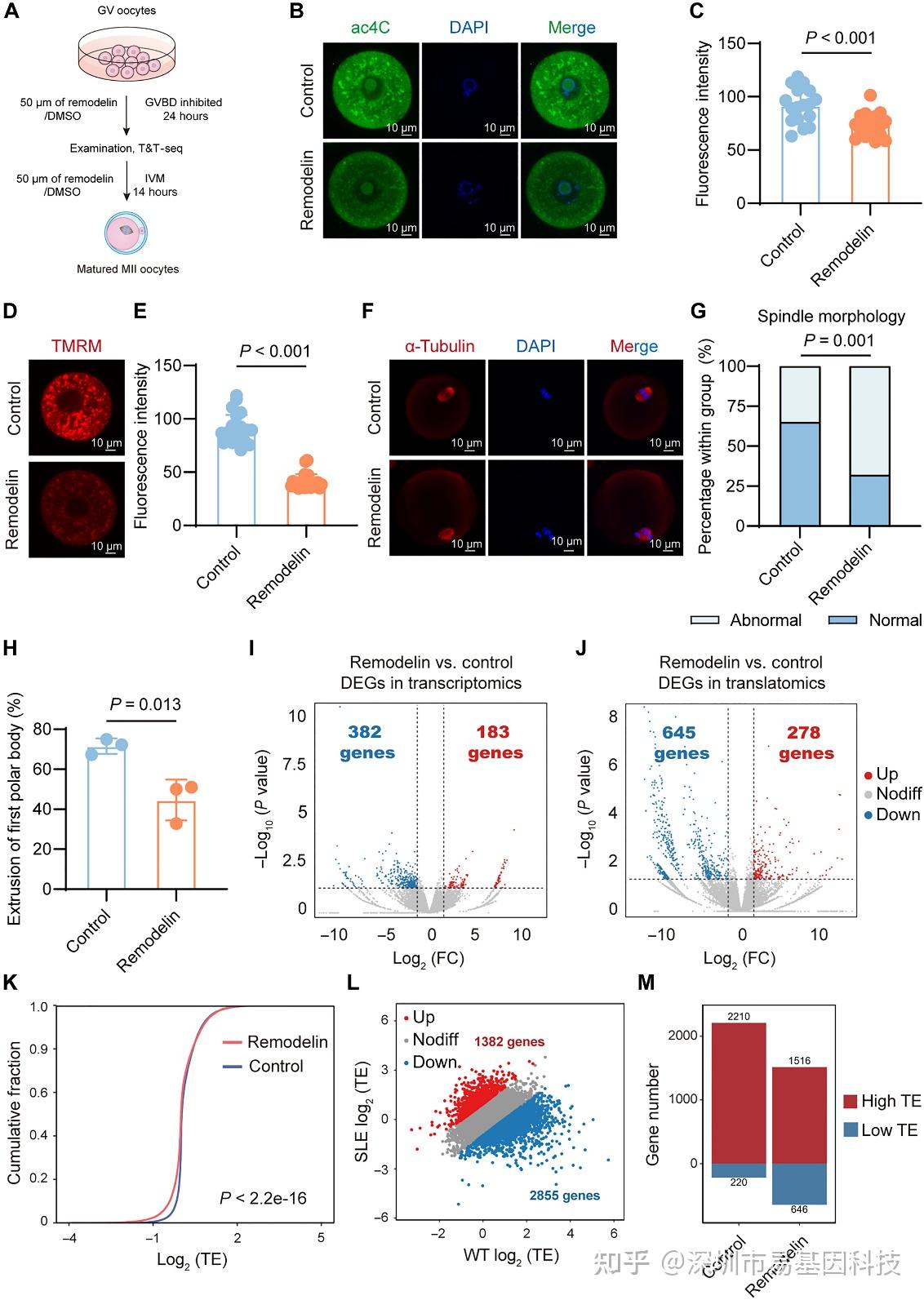
图6:体外remodelin处理小鼠卵母细胞的表型与组学图谱
(6)Zar1是SLE小鼠中ac4C修饰的重要靶基因
为鉴定ac4C直接调控的关键下游效应分子,研究对SLE小鼠GV期卵母细胞进行了微量细胞acRIP-seq,绘制了SLE卵母细胞ac4C修饰图谱。技术质控显示,三次生物学重复间ac4C信号峰分布高度一致(图7A),共捕获2757个转录本(图7B),ac4C信号峰富集于转录起始位点(TSS)和终止位点(TES)附近,并鉴定出保守的"CXX"乙酰化motifs(图7C)。九象限图分析显示,ac4C修饰基因在SLE GV期主要表现为"高转录-低翻译"特征(图7D-E),提示ac4C缺失导致转录-翻译解偶联。KEGG富集揭示这些基因参与凋亡、紧密连接、间隙连接、神经营养因子信号、核糖体、FoxO信号、肌动蛋白骨架调节及蛋白质合成等通路(图7F-G),直接与卵母细胞成熟与胚胎发育相关。
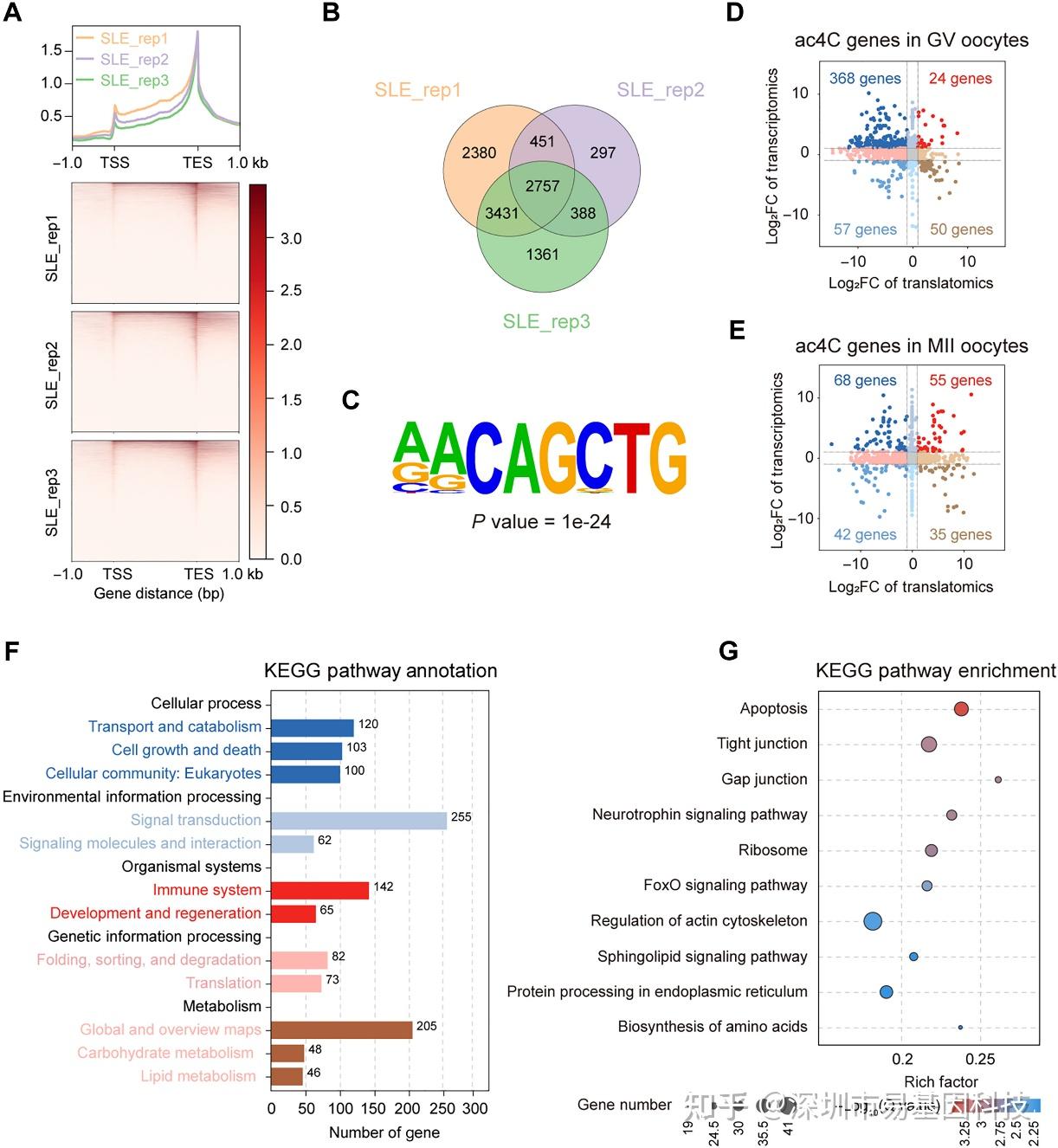
图7:SLE小鼠GV期卵母细胞的acRIP-seq图谱。
(A) SLE小鼠GV期卵母细胞mRNA ac4C修饰分布热图(三个生物学重复)。
(B) acRIP-seq靶基因重叠分析维恩图。
(C) 在卵母细胞acRIP-seq peaks中鉴定到的motifs。
(D-E) GV期和MII期卵母细胞转录组与翻译组中acRIP-seq靶基因散点图(SLE vs WT)。
(F) 对acRIP-seq鉴定出的ac4C基因进行KEGG分析。
(G) acRIP-seq鉴定出的ac4C基因代表性KEGG通路。
研究人员进一步通过将acRIP-seq靶基因、SLE下调TE基因及Remodelin下调TE基因进行交集分析,筛选出325个候选靶标,结合基因在卵母细胞中的高表达及其在卵母细胞成熟和早期胚胎发育中的已注释功能,研究鉴定出调控mRNA翻译激活与线粒体-核糖核蛋白域组装的母源效应基因Zar1(图8A-B)。acRIP-seq显示Zar1在SLE卵母细胞中ac4C富集程度显著降低(图8C),qRT-PCR与免疫荧光证实其转录水平不变但翻译水平与蛋白表达显著下降(图8D-F),且在Remodelin处理组中结果类似(图8G-H)。
上述研究结果得益于acRIP-seq技术的成功运用,从全基因组范围内筛选并验证Zar1是受ac4C修饰调控的关键下游靶基因,其翻译受损直接影响了卵母细胞的发育力。
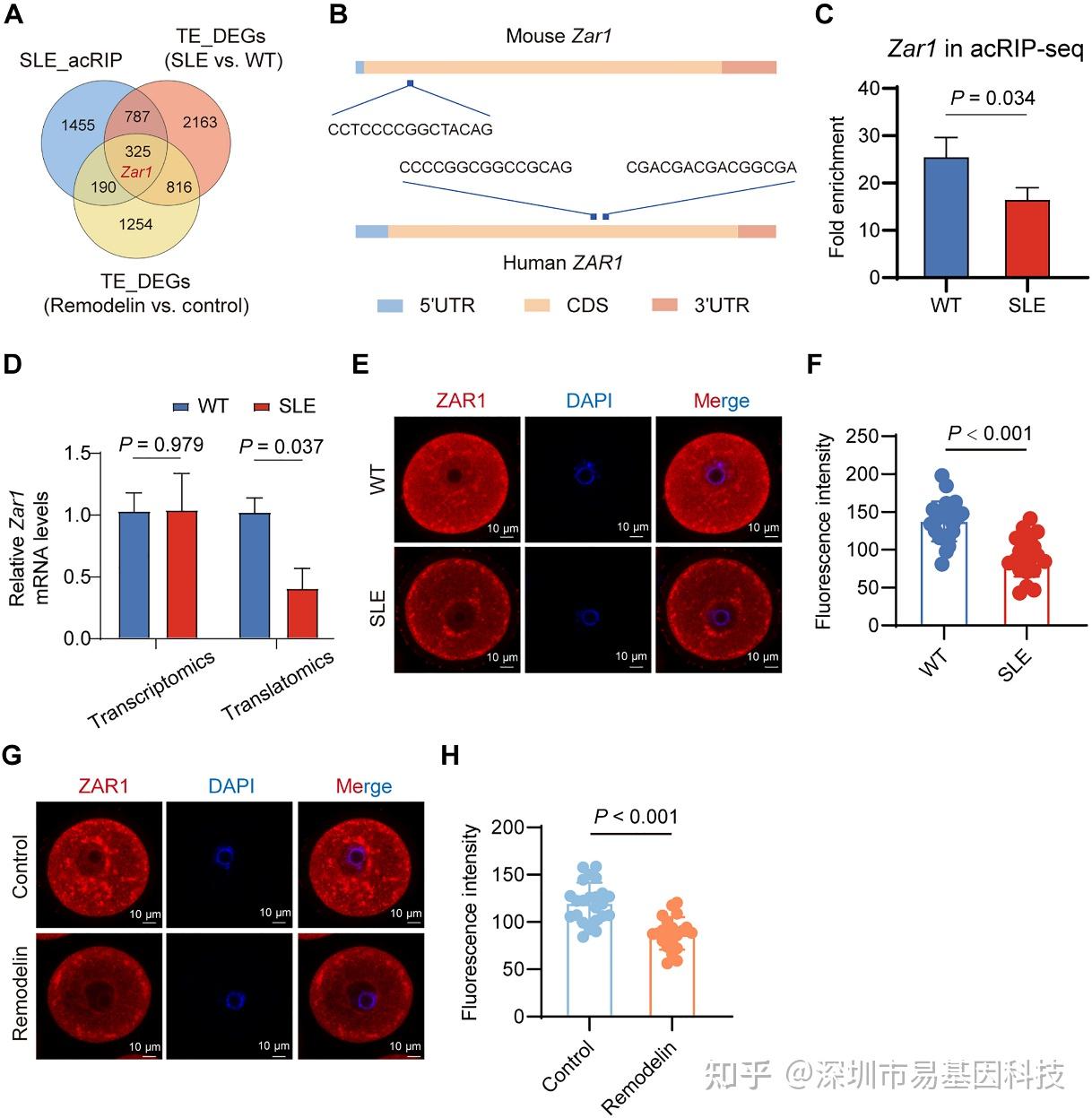
图8:Zar1是SLE卵母细胞中ac4C修饰的靶基因之一。
(A) acRIP-seq靶基因、SLE GV期卵母细胞中翻译效率(TE)下调基因以及remodelin处理卵母细胞中TE下调基因的重叠情况维恩图。
(B)人和小鼠ZAR1中潜在的ac4C修饰位点。
(C) WT与SLE小鼠GV期卵母细胞acRIP-seq中Zar1的富集倍数水平。
(D) qRT-PCR结果显示SLE与WT GV期卵母细胞中鼠Zar1 mRNA的相对表达水平。
(E-F) WT和SLE GV期卵母细胞中ZAR1(红色)和细胞核(蓝色)的免疫荧光图像及直方图。
(G-H) remodelin处理组与对照组GV期卵母细胞中ZAR1和细胞核的免疫荧光图像及直方图。
(7)烟酰胺通过增强ac4C修饰改善SLE小鼠卵母细胞数量与质量
基于SIRT1通过去乙酰化抑制NAT10活性的机制,研究假设并验证了NIA可增强SLE卵母细胞的ac4C修饰。体内预实验确定100 mg/kg为最低有效剂量,正式实验显示NIA处理的SLE小鼠GV期卵母细胞ac4C修饰水平与ZAR1蛋白表达显著回升(图9B-D)。功能表型全面改善:GV期卵母细胞数量增加(图9E),线粒体膜电位恢复(图9F-G);MII期卵母细胞数量提升(图9H),线粒体功能与纺锤体形态正常化(图9I-L),体外成熟率提高(图9M),并显示出改善胚胎发育和活产率的趋势。
上述研究结果不仅证明了通过药理学手段提升ac4C修饰水平可以挽救SLE导致的卵母细胞缺陷,还揭示了NIA兼具改善生殖结局和缓解疾病症状的双重益处,具有重要的转化医学价值。
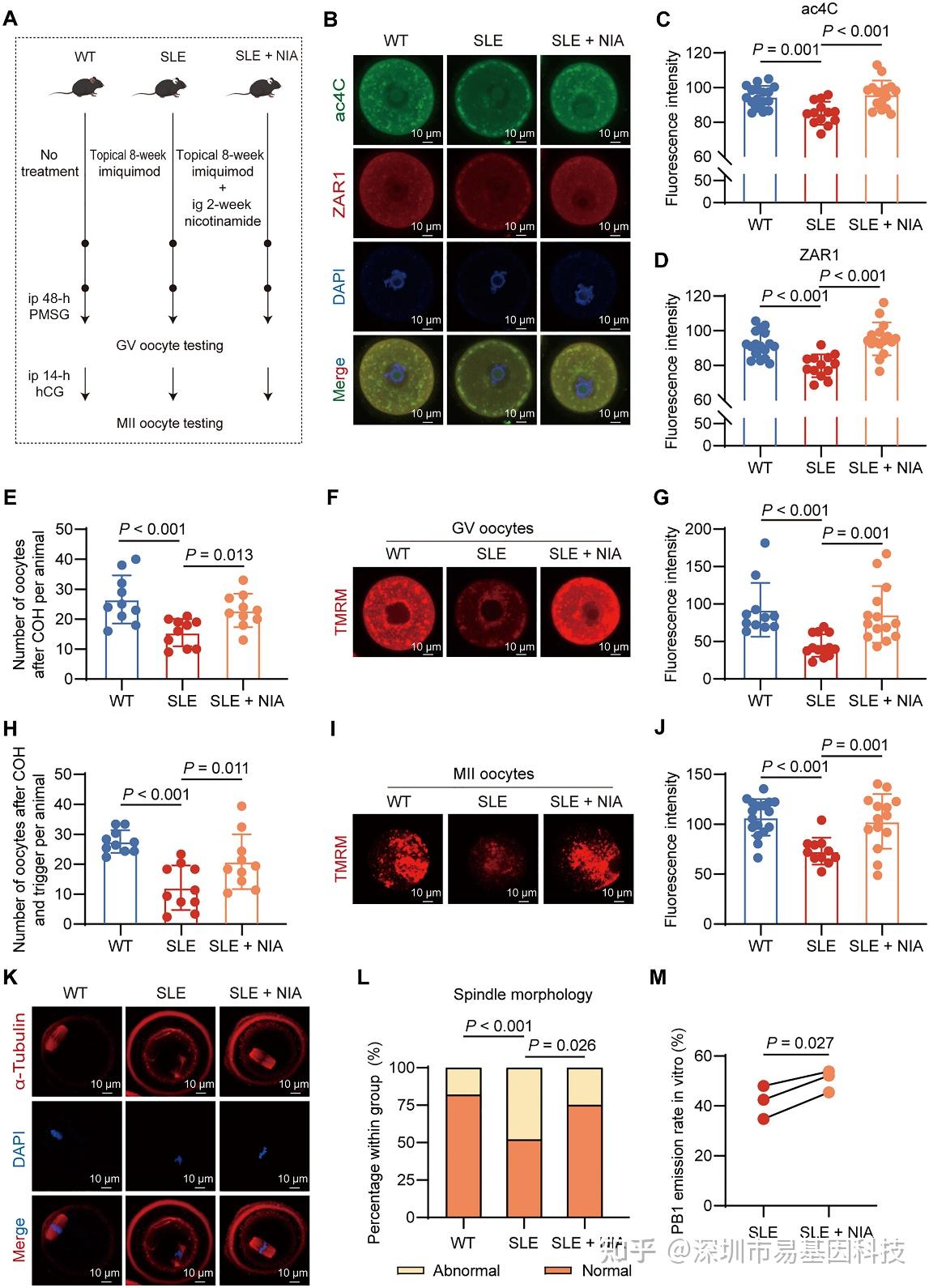
图9:烟酰胺通过增加ac4C修饰改善SLE小鼠卵母细胞的数量和质量
结论和启示
本研究通过acRIP-seq等分析揭示了SLE疾病状态下,个体抑制NAT10翻译降低卵母细胞ac4C修饰水平,导致母源性mRNA翻译效率全局性下调,关键基因Zar1表达下调引发卵母细胞成熟障碍与胚胎发育阻滞。通过功能挽救实验验证了烟酰胺通过激活NAT10-ac4C轴可安全有效地恢复卵母细胞数量与质量,改善SLE小鼠生育力。本研究强调了ac4C修饰表观调控在卵母细胞发育及生殖疾病中的关键作用。
微量细胞acRIP-seq在极少量细胞(如卵母细胞、早期胚胎、干细胞)中研究RNA修饰的动态变化、精确绘制修饰图谱并关联其功能影响提供了强大的方法学工具。未来在生殖医学、发育生物学及稀有细胞研究中具有广泛应用前景。
关于易基因ac4C乙酰化RNA免疫沉淀测序(acRIP-seq)
ac4C RNA乙酰化(N4-acetyicytidine,ac4C),N4位乙酰胞嘧啶,是真核原核生物中保守的化学修饰,早期研究认为ac4C主要存在于tRNA和18S rRNA上。近期研究显示,mRNA上也存在大量的ac4C,该修饰在促进蛋白翻译、影响RNA稳定性和可变剪接、调控基因表达发挥重要作用,是继m6A修饰之后表观转录组学的新兴发展方向。
ac4C RNA修饰的检测,易基因采用基于抗体富集的ac4C RNA乙酰化免疫共沉淀 (acetylated RNA Immunoprecipitation,acRIP)技术:基于抗体特异性结合乙酰化修饰碱基原理,以RNA免疫共沉淀富集乙酰化修饰片段为基础,然后通过高通量测序(acRIP-seq),在转录组范围内研究发生乙酰化的RNA区域,高效获得结果。
易基因提供适用于不同科研需求的acRIP -seq技术:
- ac4C乙酰化-常量mRNA acRIP -seq
- ac4C乙酰化-常量mRNA +lncRNA acRIP -seq
- ac4C乙酰化-微量mRNA +lncRNA acRIP -seq
实验原理:
首先通过poly(A)捕获RNA,将获得的RNA打成100nt左右的小片段;之后使用ac4C特异性抗体进行免疫共沉淀,含有ac4C修饰的RNA片段被富集并回收;进而对回收的RNA进行文库构建、高通量测序和生物信息学分析,通过peak分析鉴定出ac4C修饰的位点。
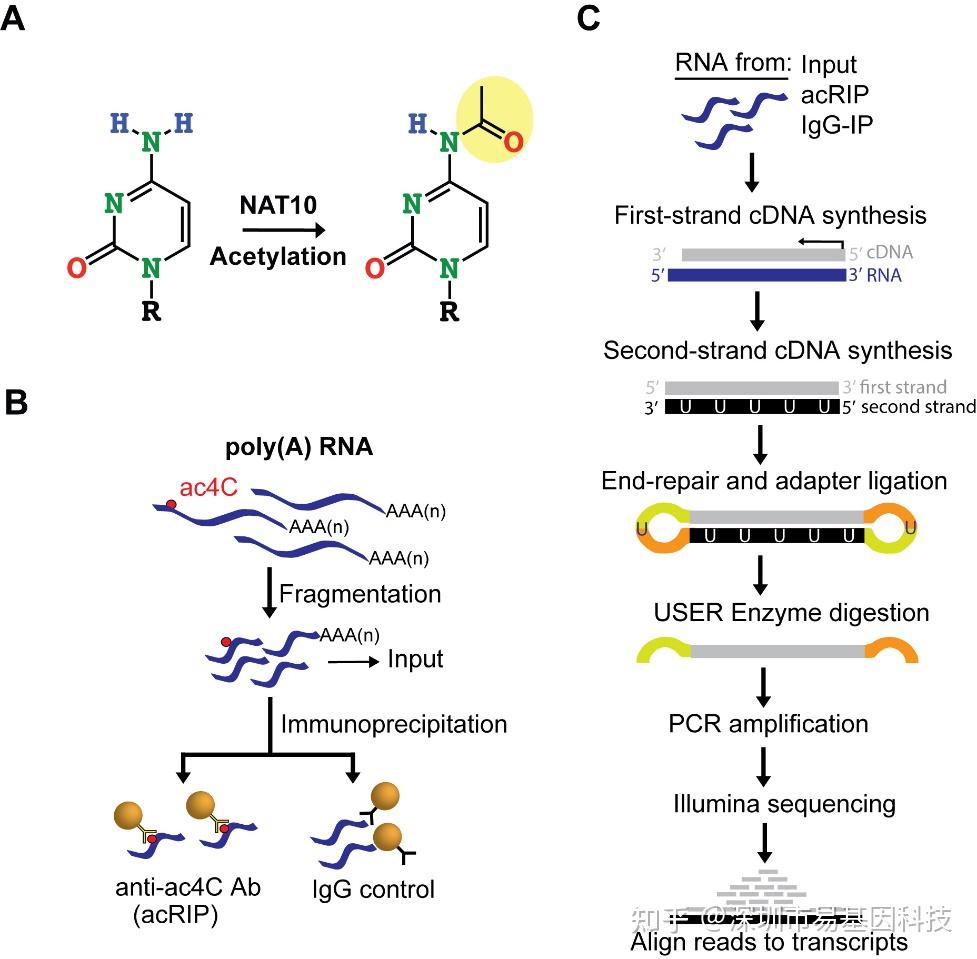
易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化、cfDNA)和表观转录组学(m6A、m5C、m1A、m7G、ac4C、RNA与蛋白互作)、DNA与蛋白互作及染色质开放性技术方案(ChIP-seq、ATAC-seq),更多表观组学或多组学研究可关注易基因公众号、网站、市场微信号等,期待与各位老师开展合作交流。
参考文献:
Xie Y, Zhou C, Guo Q, Guo Y, Guo J, Chen L, Liu X, Zeng Y, Liang Q, Wu T, Liu J, Liang X. Nicotinamide boosts oocyte quantity and quality by promoting N4-acetylation modification in lupus mice. Sci Adv. 2025 Jul 18;11(29):eadu0955. doi: 10.1126/sciadv.adu0955.
相关阅读:
1.易基因ac4C乙酰化RNA免疫沉淀测序(acRIP-seq)
2.新方向:RNA修饰N4-乙酰胞苷(ac4C)的调控机制、检测方法及其在癌症中的作用最新研究进展
3.Adv Sci浙大范衡宇团队acRIP-seq揭示哺乳动物mRNA乙酰化修饰ac4C形成机制
4.m6A/m5C/m1A/m7G/ac4C/Ψ等8种RNA修饰的生物学功能和潜在机制 | 深度综述


 浙公网安备 33010602011771号
浙公网安备 33010602011771号