易基因:微量转录组测序揭示TET酶在动物卵母细胞成熟和孤雌胚胎发育中的作用机制 | 项目文章
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
易小结
单细胞组学技术为探明哺乳动物卵母细胞早期生长分子机制提供了新机遇。此前,单细胞DNA甲基化(scBS-seq)与转录组测序(Smart-seq2)已揭示猪生发泡卵母细胞成熟的关键调控机制,阐明了减数分裂停止到恢复的分子过程(详见:项目文章 | 单细胞DNA甲基化与转录组分析揭示猪生发泡卵母细胞成熟的关键调控机制)。TET家族酶在基因组去甲基化中扮演重要角色,对胚胎发育和干细胞多能性至关重要,但在猪卵母细胞中的具体功能仍需深入探究。
本研究发现TET家族酶(TET1、TET2、TET3)在猪卵母细胞成熟和孤雌胚胎发育中发挥关键作用。Bobcat339处理通过改变5mC和5hmC水平,显著影响卵母细胞成熟、纺锤体结构、染色体排列及胚胎发育进程。此外,TET酶还通过调控合子基因组激活(ZGA)及多能性相关基因的表达,进一步影响胚胎发育。这些发现为理解TET家族在哺乳动物胚胎发育中的功能提供了新视角。
Smart-seq2技术是本研究的核心支持,其高通量转录组分析揭示了Bobcat339处理后胚胎的差异表达基因及发育停滞的分子机制。该技术为深入理解胚胎发育分子过程提供了重要线索和数据支持,为后续基因功能验证及猪生殖生物学和胚胎工程研究奠定了坚实的理论基础。
研究摘要
近日,湖北省农业科学院畜牧兽医研究所陈矾博士(助理研究员)为第一作者,黄涛副研究员和毕延震研究员为共同通讯,在《International Journal of Molecular Sciences》(Int. J. Mol. Sci. )期刊发表题为《TET Family Members Are Integral to Porcine Oocyte Maturation and Parthenogenetic Pre-Implantation Embryogenesis》的科研成果。研究通过使用Bobcat339(一种特异性的小分子TET家族抑制剂)处理以抑制TET酶活性,进而观察其对猪卵母细胞成熟和早期胚胎发育的影响。研究结果揭示了TET家族酶在调控猪卵母细胞成熟、纺锤体结构、染色体排列以及胚胎发育过程中5mC和5hmC水平的关键作用。研究阐明了TET酶在猪卵母细胞成熟和孤雌胚胎发育中的具体作用机制,为理解哺乳动物胚胎发育的表观遗传调控提供新的视角。此外研究结果也为猪的生殖生物学和胚胎工程提供重要理论基础,有助于优化猪的繁殖技术和胚胎发育调控策略。易基因科技为本研究提供微量转录组测序(Smart-seq2)技术服务。

标题:TET Family Members Are Integral to Porcine Oocyte Maturation and Parthenogenetic Pre-Implantation Embryogenesis(TET家族成员对猪卵母细胞成熟和孤雌胚胎发育至关重要)
发表时间:2023-08-05
发表期刊:Int. J. Mol. Sci.
影响因子:IF 5.6/Q2
技术平台:Smart-seq2等(易基因金牌技术)
研究方法
样本收集:从雌猪卵巢中分离3-6 mm的卵泡,收集带有均匀细胞质和多层卵丘细胞的卵丘卵母细胞复合体(cumulus oocyte complexes, COCs)。
体外成熟(IVM):将COCs在培养基中培养,添加促性腺激素(eCG和hCG)以促进卵母细胞成熟。
孤雌激活:去除卵丘细胞后,激活卵母细胞,激活后的卵母细胞在培养基中培养。
Bobcat339处理:将Bobcat339溶解于DMSO中,稀释至不同浓度(0μM、50μM、100μM、200μM、400μM),添加到成熟培养基中以抑制TET酶活性。
检测方法:
免疫荧光染色:检测5mC和5hmC水平。
qRT-PCR:用于检测基因表达水平。
微量RNA测序(Smart-seq2):分析胚胎转录组的变化。
结果图形
(1)Bobcat339处理阻断猪卵母细胞第一极体(First Polar Body)排出
实验中,不同浓度的Bobcat339处理显著降低了猪卵母细胞第一极体排出率(PBE),表现为浓度依赖性。在200μM和400μM浓度下,PBE率显著下降,表明Bobcat339抑制TET酶活性后,卵母细胞成熟过程受到阻碍。
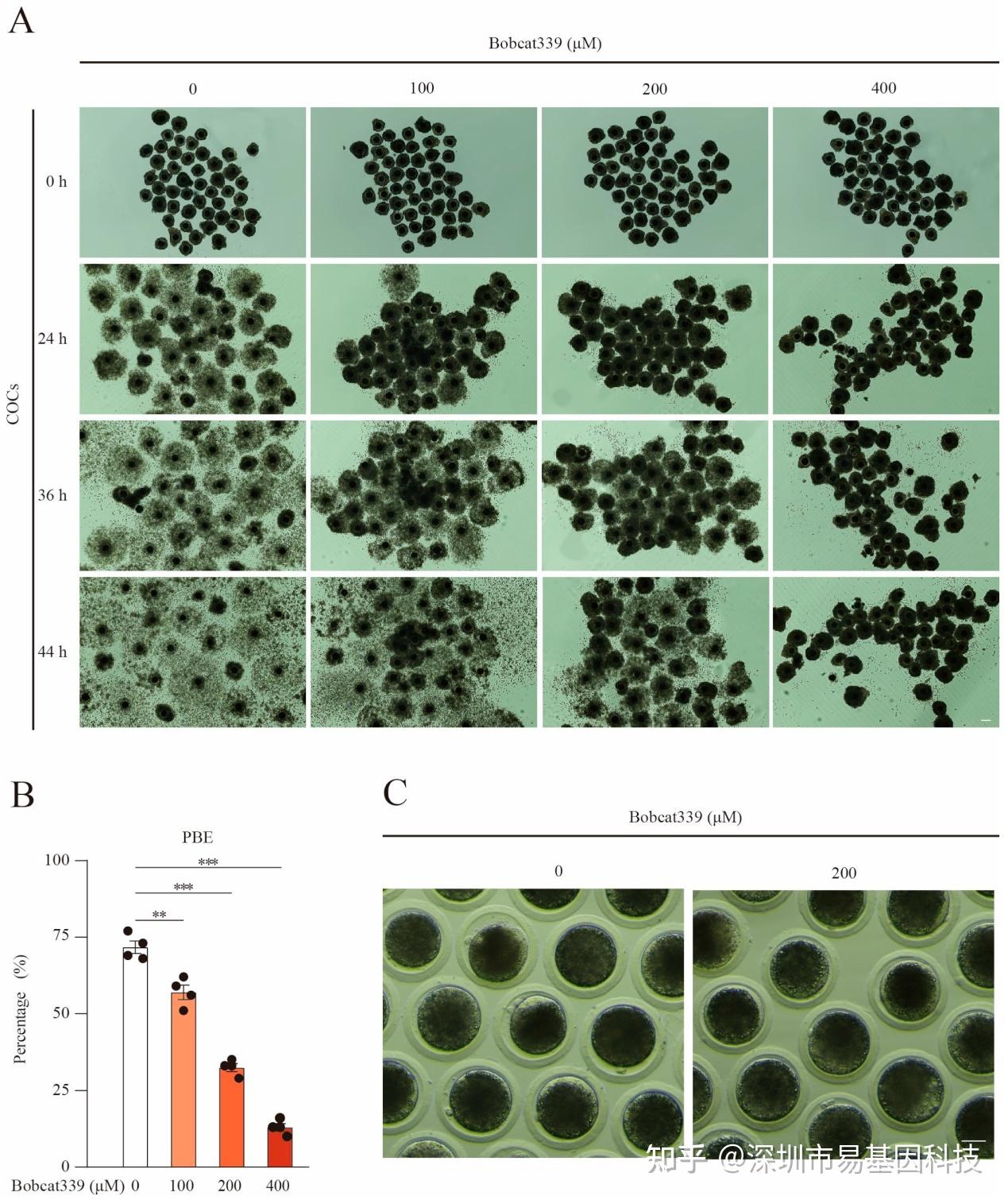
图1:Bobcat339处理抑制了猪卵母细胞成熟。
(A)对照组和经Bobcat339处理(0、100、200和400 μM)的卵丘卵母细胞复合体(COCs)在体外培养24、36和44小时后的代表性图像。对照组的卵丘细胞扩张良好,而Bobcat339处理组的卵丘细胞扩张较少且更加黏附。
(B)经100μM、200μM和400μM Bobcat339处理后,第一极体排出(PBE)率显著降低。
(C)对照组和经200μM Bobcat339处理的卵母细胞在体外培养44小时后的第一极体排出的代表性图像。
(2)经Bobcat339处理引发猪卵母细胞凋亡
通过Annexin-V-FITC染色检测早期凋亡水平,发现Bobcat339处理后的卵母细胞早期凋亡率显著增加。此外,BAX和BCL-2的mRNA水平显著升高,BAX/BCL-2比值显著上升,表明TET酶抑制导致卵母细胞早期凋亡。
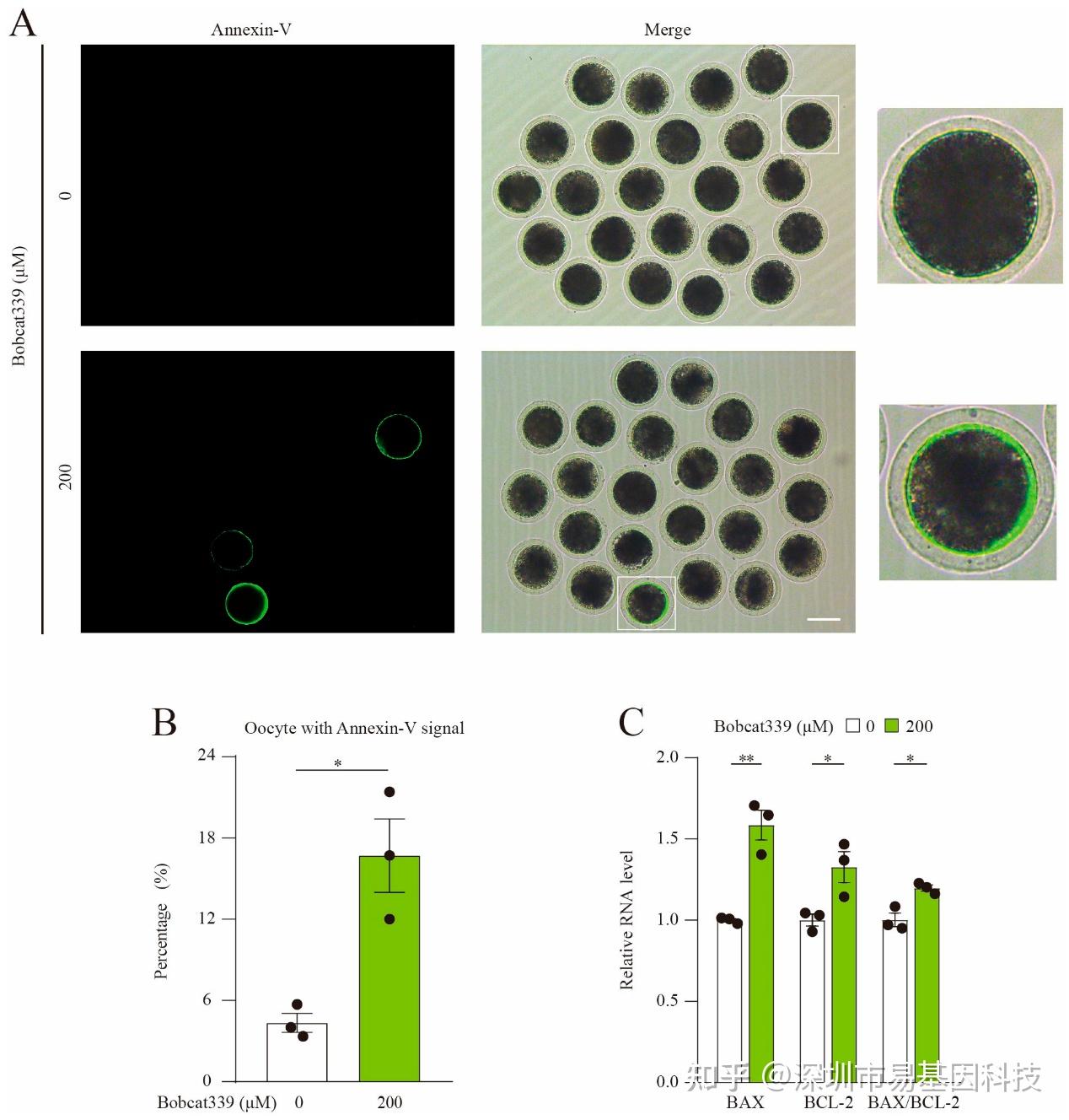
图2:Bobcat339处理诱导猪卵母细胞早期凋亡。
(A)对照组和经Bobcat339处理的卵母细胞的早期凋亡荧光信号。
(B)对照组和经Bobcat339处理的卵母细胞中带有Annexin-V信号的卵母细胞比例。
(C)qRT-PCR检测对照组和经Bobcat339处理的卵母细胞BAX、BCL-2、BAX/BCL-2的mRNA水平。
(3)Bobcat339对卵母细胞纺锤体结构和染色体排列的作用
使用α-tubulin染色观察纺锤体形态,结果显示Bobcat339处理的卵母细胞纺中锤体结构异常,染色体排列分散。与对照组相比,异常纺锤体和染色体排列比例显著增加,表明TET酶对卵母细胞的纺锤体结构和染色体排列具有重要作用。
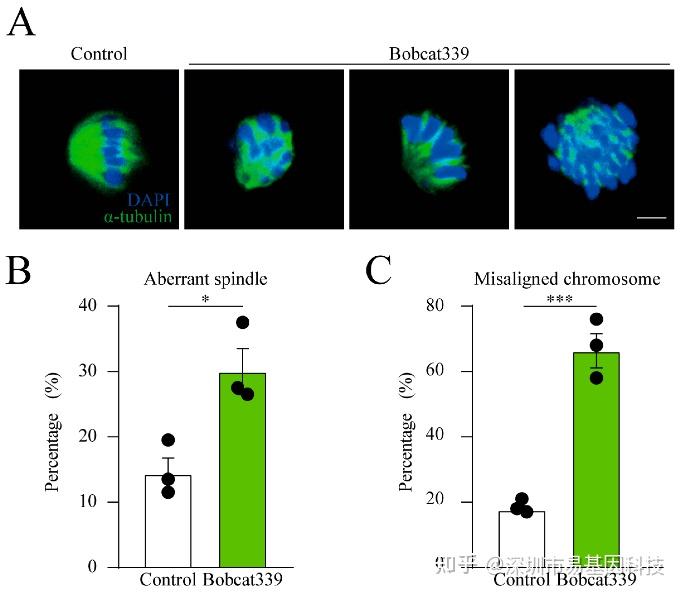
图3:Bobcat339对纺锤体形态和染色体排列的影响。
(A)对照组和经Bobcat339处理的卵母细胞(200μM Bobcat339)的纺锤体形态和染色体排列图像。
(B)经Bobcat339处理的卵母细胞中异常纺锤体比例显著增加。
(C)经Bobcat339处理的卵母细胞中染色体错位比例显著升高。
(4)Bobcat339处理导致猪卵母细胞中的5mC/5hmC水平发生变化
免疫荧光染色结果显示,Bobcat339处理的卵母细胞中5hmC信号显著降低,而5mC信号显著增加。定量分析进一步验证这一结果,表明TET酶通过调节5mC和5hmC水平影响卵母细胞成熟。
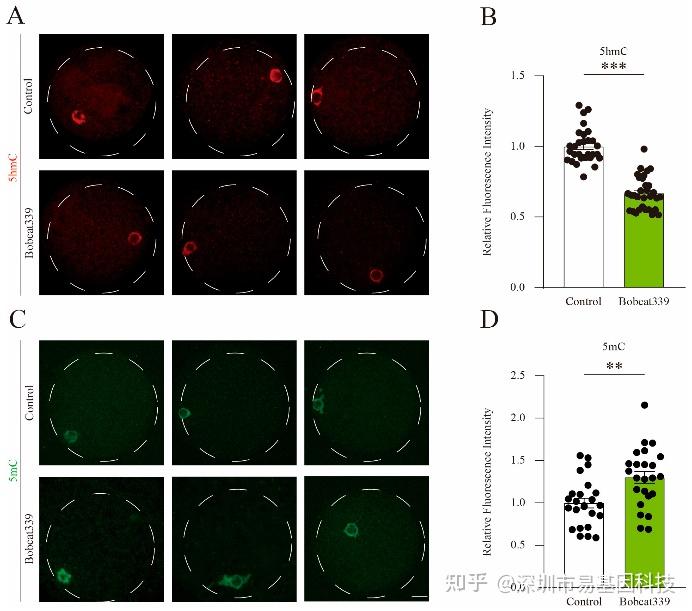
图4:Bobcat339处理改变了猪卵母细胞中的5mC和5hmC水平。
(A)猪卵母细胞中5hmC的免疫荧光染色。
(B)对照组和经Bobcat339处理的卵母细胞中5hmC的荧光强度。
(C)对照组和经Bobcat339处理的卵母细胞中5mC的免疫荧光染色。
(D)对照组和经Bobcat339处理的卵母细胞中5mC的平均荧光强度。
(5)Bobcat339对胚胎发育的影响
在孤雌胚胎发育实验中,不同浓度的Bobcat339处理显著降低了胚胎发育到囊胚阶段的比例。胚胎在4细胞阶段停滞,表明Bobcat339抑制TET酶活性后,胚胎发育受到严重影响。
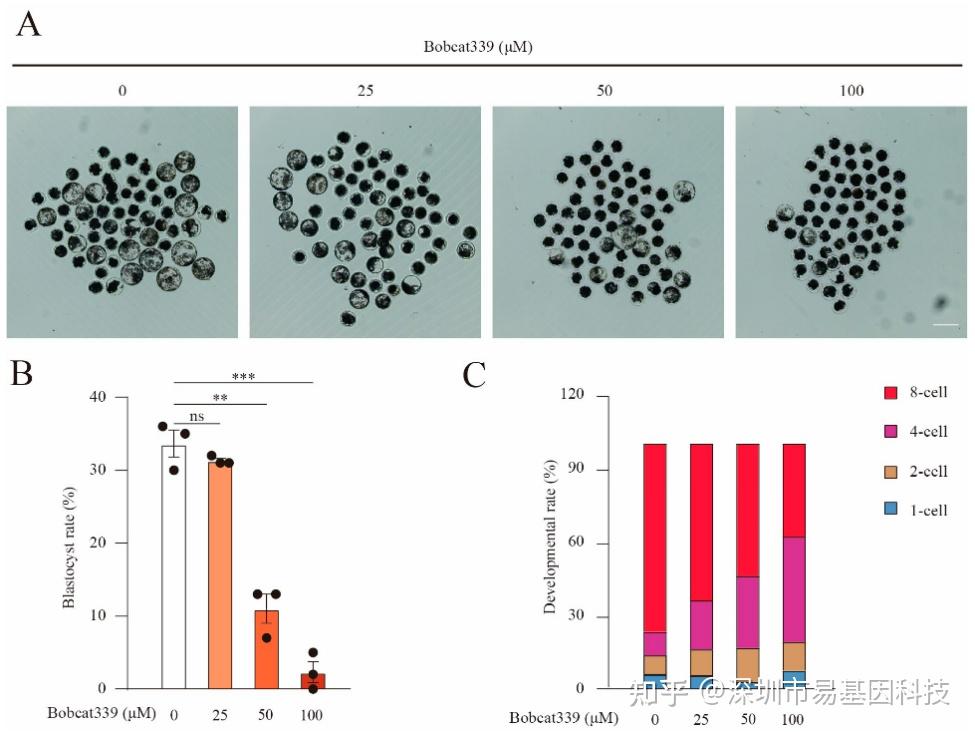
图5:Bobcat339处理抑制了猪的早期胚胎发育。
(A)对照组和经Bobcat339处理(25、50和100 μM)的孤雌激活猪胚胎在第6天囊胚形成的图像。
(B)对照组和经Bobcat339处理组中发育到囊胚阶段的激活卵母细胞比例。
(C)对照组和经Bobcat339处理(25、50和100 μM Bobcat339)组中第3天不同阶段的胚胎比例。
(6)Bobcat339处理降低了ZGA和多能性相关基因的表达
qRT-PCR检测结果显示,Bobcat339处理后,合子基因组激活(zygotic gene activation,ZGA)标记基因(如EIF1A和DPPA2)以及多能性相关基因(如OCT4和NANOG)的mRNA水平显著下降,表明Bobcat339处理破坏了ZGA,影响胚胎发育。
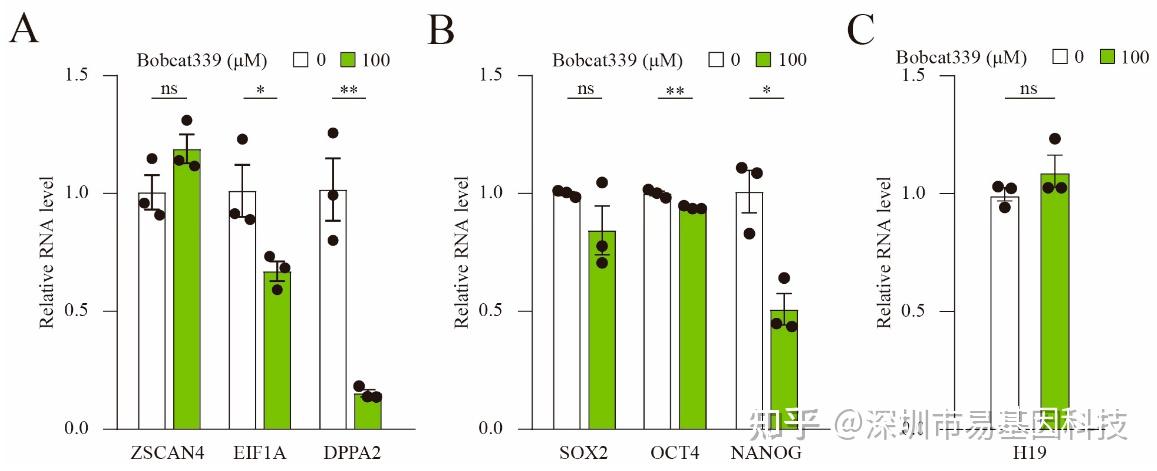
图6:Bobcat339处理阻断了ZGA和多能性基因的表达。
(A)经Bobcat339处理的胚胎中,EIF1A和DPPA2的mRNA水平显著降低。
(B)经Bobcat339处理的胚胎中,OCT4和NANOG的mRNA水平降低;SOX2的mRNA水平则没有变化。
(C)Bobcat339处理后,H19的mRNA水平未受影响。
(7)Bobcat339处理影响猪胚胎中的5mC/5hmC水平
免疫荧光染色和定量分析显示,Bobcat339处理的胚胎中5hmC水平显著降低,而5mC水平显著增加,表明TET家族酶通过调节5mC和5hmC水平影响胚胎发育。
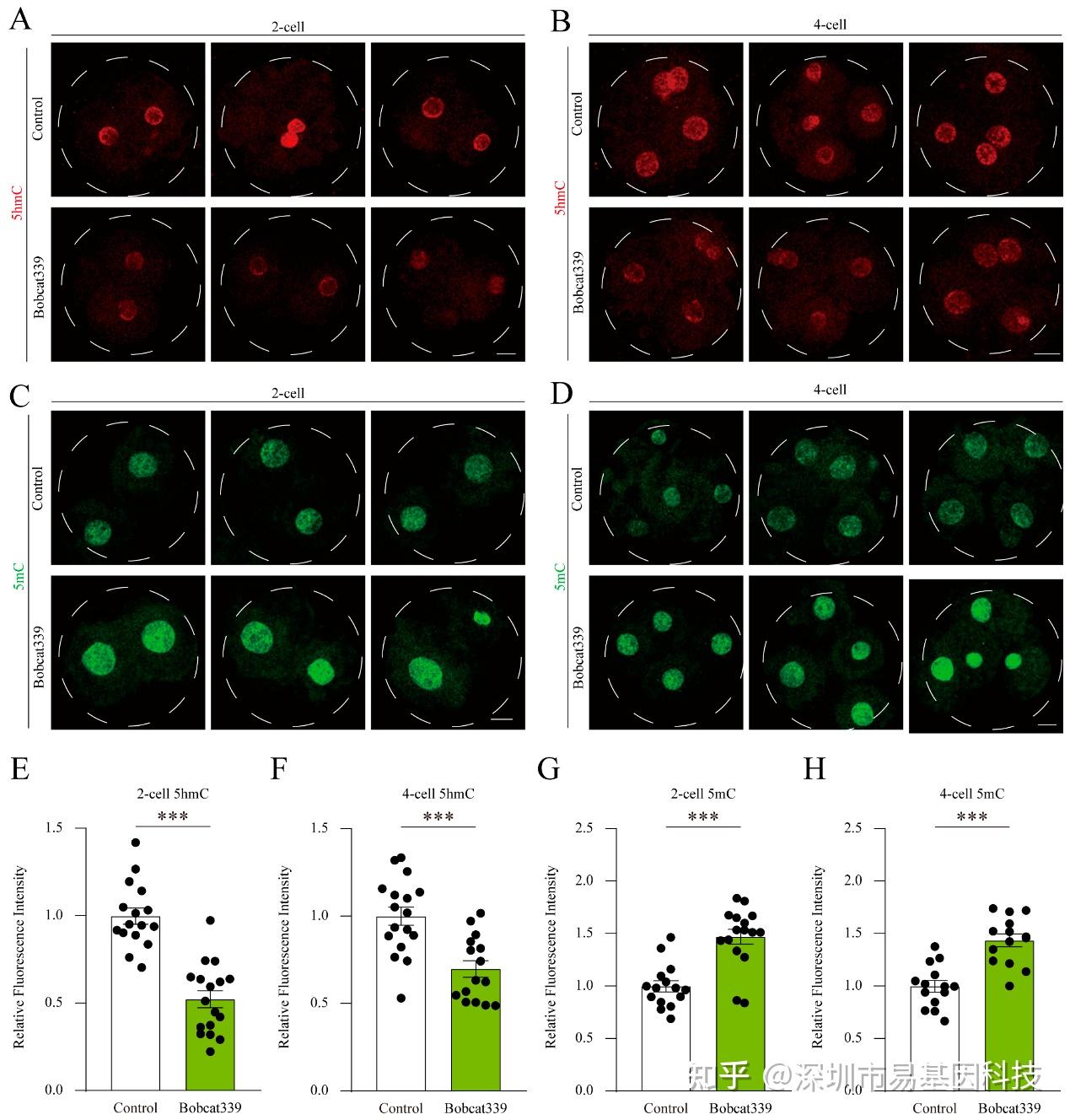
图7:Bobcat339处理影响猪胚胎中的5mC和5hmC水平。
(A-B) 对照组和经Bobcat339处理的胚胎在2细胞和4细胞阶段的5hmC免疫荧光染色。
(C-D) 对照组和经Bobcat339处理的胚胎在2细胞和4细胞阶段的5mC免疫荧光染色。
(E-F) 在对照组和经Bobcat339处理的胚胎中,2细胞和4细胞阶段的5hmC荧光强度。
(G-H) 在对照组和经Bobcat339处理的胚胎中,2细胞和4细胞阶段的5mC平均荧光强度。
(8)微量转录组数据的比较分析
通过Smart-seq2技术对4细胞阶段的胚胎进行RNA测序分析,分析结果鉴定出Bobcat339处理后胚胎中的203个差异表达基因(DEGs),其中75个上调基因,128个下调基因。基因本体(GO)分析显示,这些差异表达基因主要富集在细胞增殖、细胞组分与线粒体相关以及细胞黏附分子结合等生物学过程中。
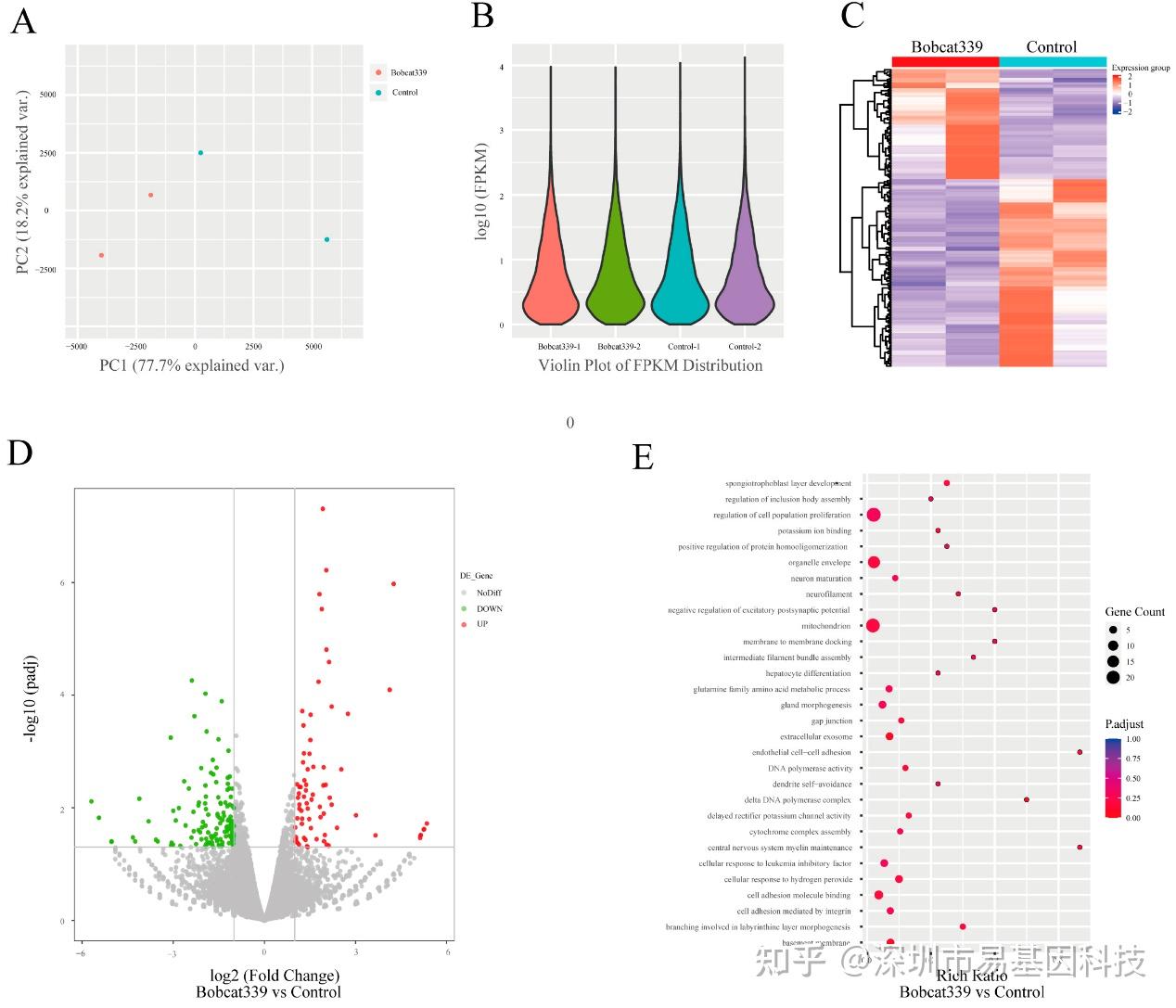
图8:对照组和经Bobcat339处理的胚胎之间的差异基因表达模式。
(A)对照组和经Bobcat339处理的胚胎在4细胞阶段的mRNA水平的主成分分析(PCA)。
(B)对照组和经Bobcat339处理组之间的基因表达和分布的小提琴图。
(C)对照组和经Bobcat339处理的胚胎在4细胞阶段的差异表达基因(DEGs)的分层聚类。
(D)对照组和经Bobcat339处理的胚胎在4细胞阶段DEGs火山图。红色(上调)/绿色(下调)。
(E)基因本体(GO)分析显示DEGs在某些生物学过程、分子功能和细胞组分中富集。
关于易基因单细胞/微量转录组测序(smart-seq2)
Smart-seq2技术在单细胞水平对带Poly(A)的RNA进行全长转录组扩增及高通量测序,能够满足高灵敏度、低偏好性的cDNA扩增,得到全长转录本,实现高水平的序列模板转换。
Smart-seq2技术有较好的覆盖范围,可检测到稀有转录本,无需额外的专业设备,应用范围较广,可以解决传统 RNA 定量技术在早期胚胎发育、干细胞、癌症、免疫等研究领域中存在的样品量极低或细胞异质性的问题,是在单细胞水平研究基因表达强有力的工具,极大地拓展了RNA-seq 的应用范围。
技术优势:
(1)起始量低:1-1000个细胞或10pg-10ng total RNA即可高效扩增;
(2)转录本覆盖度高:通过双端引物扩增全长cDNA,获得全转录组信息,避免3’端和5’端偏好性,产物完整性好;
(3)检测灵敏度高:大幅度增加了低表达基因的检出量;
(4)碱基分辨率高:可达单碱基分辨率,且可以定位到具体基因的具体转录本;
(5)实验可控:质控点多,可从实验的开端判断细胞状况。
研究方向:
可应用于细胞分子机制中细胞异质性研究,解决因样本量少而无法进行高通量测序的情况。
- 免疫学研究
- 肿瘤及微环境研究
- 绘制组织精细化表达图谱
- 早期胚胎发育
易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化、cfDNA)和表观转录组学(m6A、m5C、m1A、m7G、ac4C、RNA与蛋白互作)、DNA与蛋白互作及染色质开放性技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900。
参考文献:Chen, F.; Li, M.-G.; Hua, Z.-D.; Ren, H.-Y.; Gu, H.; Luo, A.-F.; Zhou, C.-F.; Zhu, Z.; Huang, T.; Bi, Y.-Z. TET Family Members Are Integral to Porcine Oocyte Maturation and Parthenogenetic Pre-Implantation Embryogenesis. Int. J. Mol. Sci. 2023, 24, 12455. https://doi.org/10.3390/ijms241512455
相关阅读:
1、项目文章 | Nat Commun:单细胞转录组测序揭示光疗通过脑膜淋巴系统改善AD和衰老
2、项目文章 | 单细胞DNA甲基化与转录组分析揭示猪生发泡卵母细胞成熟的关键调控机制
3、项目文章 | 单细胞转录组测序(scRNA-seq)揭示猪窦卵泡细胞异质性和通讯模式
4、项目文章 | JGG:单细胞甲基化+转录组多组学分析揭示哺乳期母体低蛋白饮食对子代的跨代传递
5、项目文章|微量转录组测序揭示槟榔碱、咖啡因和尼古丁对神经系统转录水平的作用
6、单细胞转录组测序:Smart-seq2和10X Genomics Chromium怎么选?
7、2024项目文章精选:DNA甲基化、RNA甲基化(m6A/m5C)、ChIP-seq、单细胞转录组、宏基因组|年终盘点



 浙公网安备 33010602011771号
浙公网安备 33010602011771号