影像+病理+转录组+基因组+蛋白组多模态的胶质瘤分型 R包已发布可以直接使用 居然使用R语言分析的 !

MOFSR包:https://github.com/Zaoqu-Liu/MOFS
胶质瘤是成人最常见的恶性脑肿瘤,其中IDH野生型胶质母细胞瘤(GBM)恶性程度最高,5年生存率不足10%。由于其基因组、转录组等层面的高度异质性,传统单模态分型难以精准指导治疗。近期发表于《Nature Communications》的研究通过整合影像-病理-蛋白基因组学多模态数据,构建了全新的分型框架,为胶质瘤精准诊疗提供了新思路。
一、数据来源
数据覆盖肿瘤的解剖(影像)、细胞(病理)、遗传(基因组)、功能(转录组/蛋白质组)多个维度,为多模态融合奠定基础
研究纳入1194例IDH野生型成人胶质瘤患者,按数据完整性分为三个队列:
- FAHZZU1队列(122例):包含完整多模态数据,包括术前多参数MRI(T1WI、CE-T1WI、T2WI等)、病理切片(WSI)、全外显子测序(WES)、RNA测序(RNA-seq)及蛋白质组学数据,作为核心训练集。
- FAHZZU2队列(80例):含RNA-seq和部分蛋白质组数据,用于验证。
- FAHZZU3队列(992例):仅含MRI数据,用于非侵入性模型验证。
二、数据处理
影像数据(MRI):
- 先通过
N4ITK算法校正偏置场,再将多序列MRI(T1WI、CE-T1WI等)刚性配准至CE-T1WI模板,实现空间对齐; - 由资深放射科医生手动勾画肿瘤感兴趣区域(VOI),包含增强区、非增强区及坏死区;
- 用
PyRadiomics提取5929个特征(一阶统计量、纹理特征等),通过组内相关系数(ICC≥0.75)筛选出4271个可靠特征。
病理数据(WSI):
- 将HE染色切片扫描为数字全切片图像,转换至Lab色彩空间后用
Otsu算法分割组织区域; - 裁剪为1024×1024像素的病理块,用
CellProfiler提取细胞形态、密度等特征。
组学数据:
- WES数据:构建突变二进制矩阵(0=野生型,1=突变),计算拷贝数变异(CNV),保留VAF≥5%的可靠突变;
- RNA-seq数据:转换为log2(FPKM)值,标准化后保留高表达基因;
- 蛋白质组数据:归一化为log2强度值,确保样本间可比性。
特征筛选:计算各模态特征的中位数绝对偏差(MAD),选取高变异特征;结合聚类预测指数(CPI)和GAP统计量,确定最优输入特征组合(共2640种组合中筛选)。
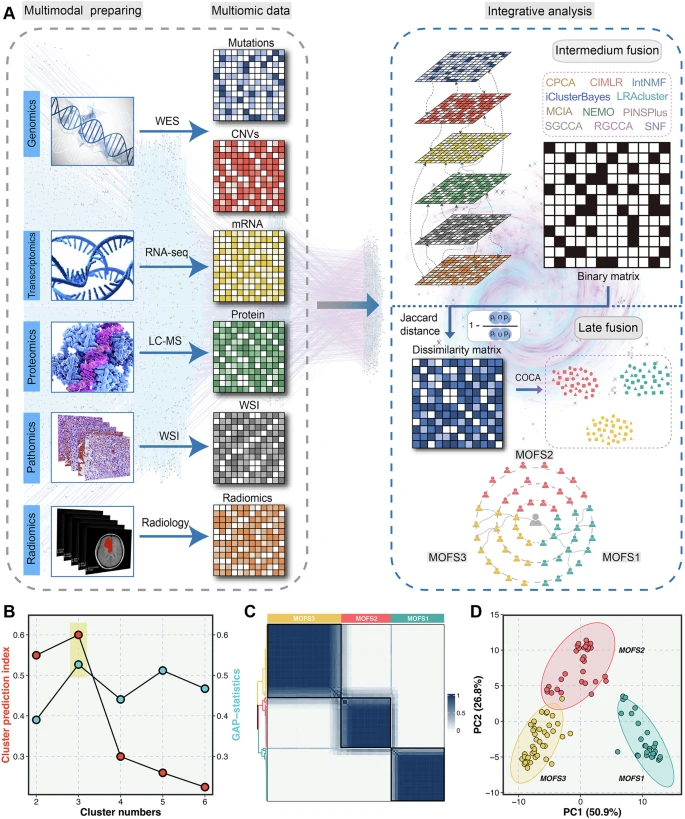
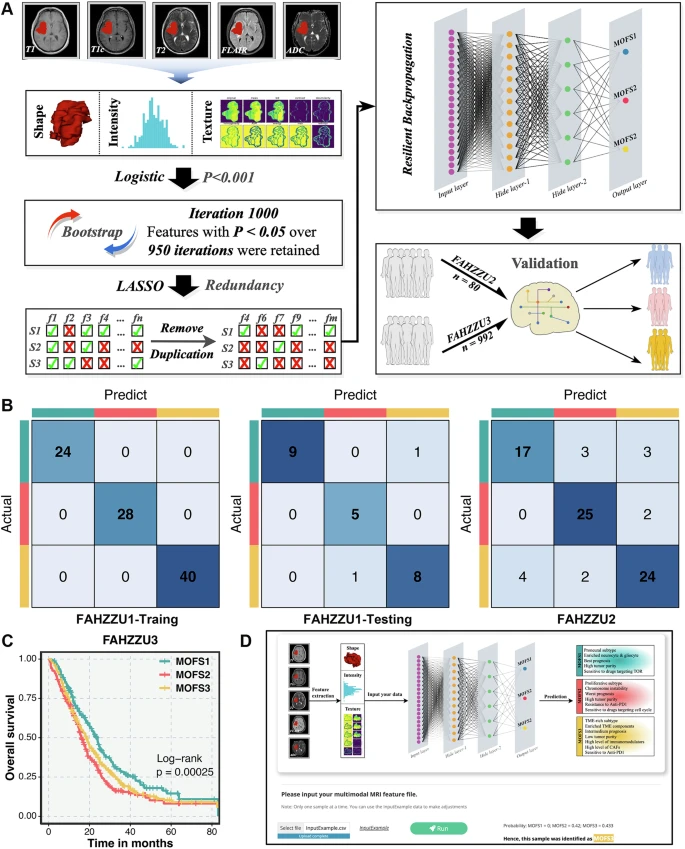
三、多模态融合框架(MOFS)构建
新性地采用“中间融合+晚期融合”策略
- 中间融合:对122例FAHZZU1患者,把上一步得到的特征合并,通过多种聚类方法得到不同的聚类结果(11种结果)
- 晚期融合:将11组结果转换为二进制矩阵(样本-聚类标签,即这个样本种是否分到了这个cluster),计算样本间Jaccard相似度;通过“聚类的聚类(
COCA)”方法对10000次重抽样结果进行整合,最终确定最优聚类数为3(K=3),得到稳定的三亚型分型。
三、模型结果:亚型特征与临床价值
1. 三亚型的生物学与临床特征
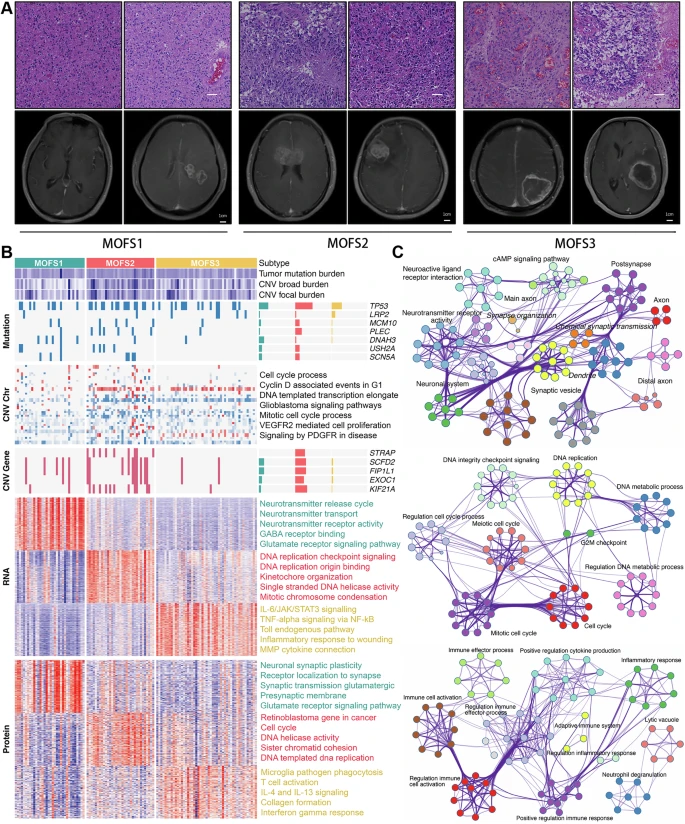
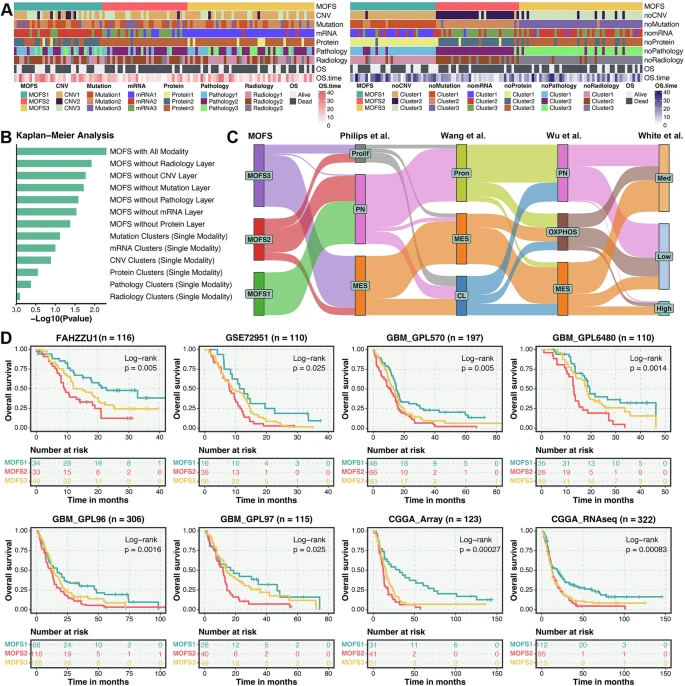
通过多模态融合,研究识别出三个具有显著差异的亚型:
- MOFS1(proneural亚型):神经发育相关通路富集,肿瘤增强弱、细胞异型性低,预后最佳(中位生存期最长);
- MOFS2(proliferative亚型):细胞周期通路活跃,基因组不稳定(CNV负荷高),肿瘤呈团块状增强,预后最差;
- MOFS3(TME-rich亚型):免疫和基质成分丰富,肿瘤呈环状增强伴坏死,对PD-1抑制剂敏感,预后中等。
-![]()
2. 多模态融合的优越性
- 单模态聚类(如仅用转录组或影像)与MOFS亚型一致性低,且无法有效区分预后;而排除任一模态后,多模态分型仍保持高一致性和显著预后价值。
- 在8个外部队列(含CGGA、GEO数据库)中,三亚型的生存差异均显著(P<0.05),验证了分型的稳定性。
![]()
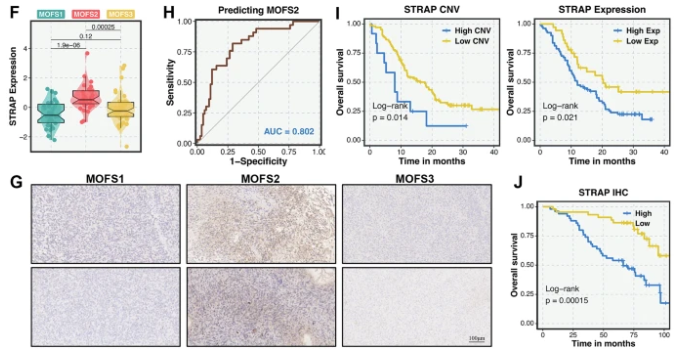
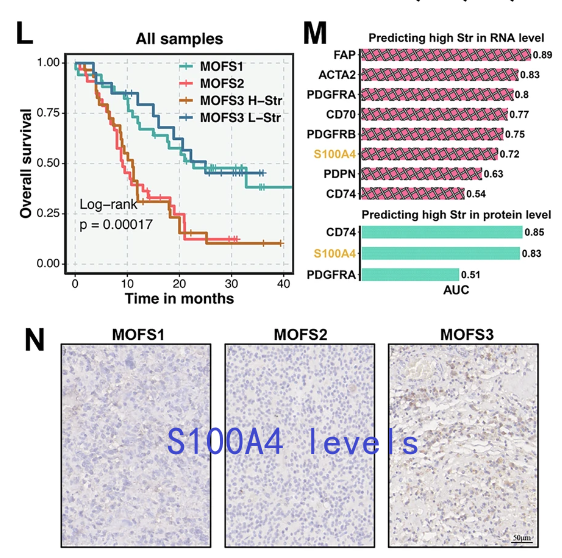
3. 潜在标志物与临床转化
MOFS2:发现STRAP基因扩增/高表达与不良预后显著相关(AUC=0.802),是潜在治疗靶点;
-
MOFS3:基质丰度可进一步细分预后(高基质组生存期短),S100A4蛋白可作为基质丰度的标志物(AUC=0.83);
-![]()
-
开发基于MRI的深度神经网络(DNN)分类器,通过22个影像特征实现非侵入性亚型预测(测试集准确率0.917),为临床快速分型提供工具。
![]()

 浙公网安备 33010602011771号
浙公网安备 33010602011771号