Cell Discov | 丁酰化修饰组学研究揭示癌症耐药新机制

景杰生物 | 报道
尽管癌症治疗手段已取得了一些突破,但耐药性仍是阻碍癌症成功治疗的主要因素。基因组的研究已经发现了一些耐药相关机制,包括一些影响DNA损伤修饰的信号通路、跨膜运输、自噬和线粒体功能障碍等,但是基于基因组的分析不能完全阐释化疗耐药性的复杂机制。蛋白质组学和蛋白质翻译后修饰组学可以为扩展耐药机制发现的更多可能性。如Cell报道的蛋白基因组学揭示高级别浆液性卵巢癌化疗耐药性机制;Gastroenterology基于蛋白质组学发现胰腺癌吉西他滨耐药新机制;Nature Genetics报道的利用蛋白质组学、空间蛋白组学揭示了高级别浆液性卵巢癌终末期疾病的病理机制以及对药物治疗的耐药性;Cancer Cell报道的O-糖基化修饰介导的促肿瘤转移和化疗抵抗新机制等等。
近来,高分辨率质谱技术的发展助力多种新型酰化修饰的发现和癌症领域的研究。广州医科大学附属第五医院李斌课题组报道了非组蛋白NAT10的2-羟基异丁酰化修饰是癌症转移的关键机制,极大地支持了癌症治疗新策略的探索和有效抗肿瘤药物的开发 [1]。丁酰化修饰Kbu是一种进化保守的新型酰化修饰,已在多个物种中被发现,然而,丁酰化在肿瘤耐药中的生物学功能未见报道,修饰酶和去修饰酶更有待进一步挖掘,值得深入研究。
近日,广州医科大学附属第五医院李斌课题组再次在权威期刊Cell Discovery (IF=33.5) 发表题为“Lysine butyrylation of HSP90 regulated by KAT8 and HDAC11 confers chemoresistance”的最新研究成果。该研究对食管鳞状细胞癌 (ESCC)的化疗敏感和化疗耐药细胞系进行了丁酰化修饰组学 (Kbu) 分析,报道了HSP90 K754丁酰化修饰在化疗耐药中的关键作用。研究还首次阐明了KAT8和HDAC11分别是HSP90丁酰化修饰的Writer和Eraser,而SDCBP与HDAC11竞争性结合HSP90,从而维持了HSP90的丁酰化修饰和稳定性。该研究首次描绘了癌症丁酰化修饰的全局景观,同时为肿瘤的化疗耐药性提供了新的思路。景杰生物为该研究提供了丁酰化修饰组学技术支持与系列新型酰化修饰泛抗体。

1 首次绘制癌症丁酰化修饰全局景观
首先研究团队利用11种修饰泛抗体,检测ESCC化疗敏感和耐药的细胞系,发现只有丁酰化修饰水平存在显著变化。随后,研究人员对亲代细胞KYSE150以及5-Fu耐药细胞KYSE150-FR进行了系统的蛋白质组学和丁酰化修饰组学分析。研究总共发现105个蛋白的123个修饰位点存在显著差异。
接下来研究团队对组学数据进行了更深入的生信挖掘,以确定与化疗耐药相关的关键蛋白和关键修饰位点。蛋白互作网络分析和GO富集分析表明HSP90可能在化疗耐药中发挥了重要作用。临床样本的检测发现,复发样本中HSP90的表达更高,而且在5-Fu耐药的样本中,HSP90的丁酰化修饰也显著上调。以上结果提示HSP90的丁酰化修饰可能在ESCC化疗耐药中发挥了关键作用。
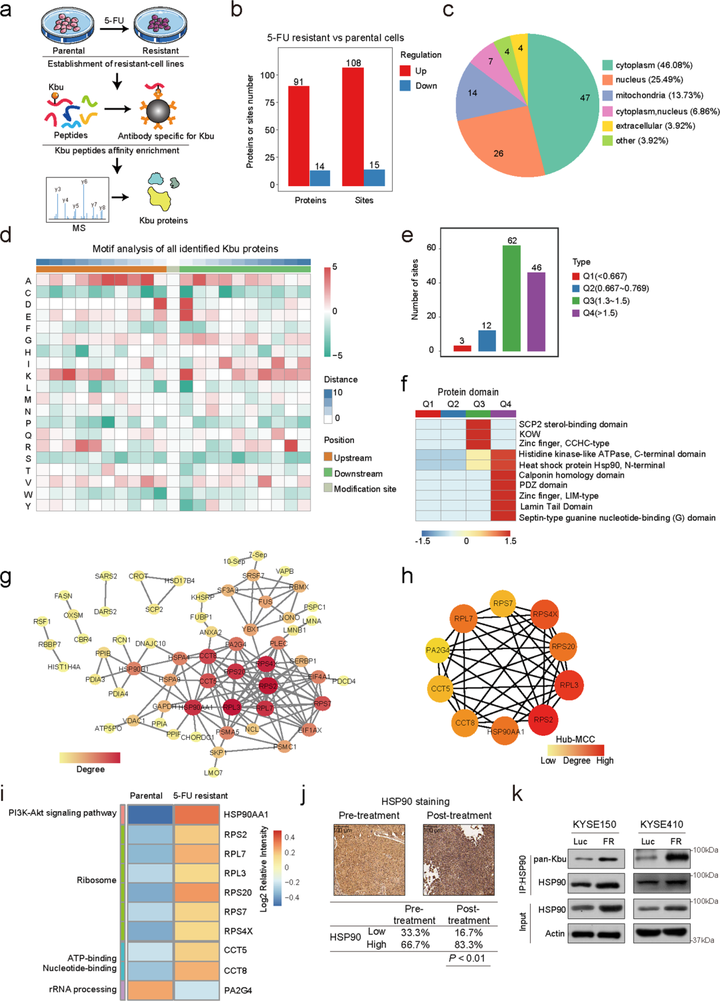
图1 化疗敏感和化疗耐药ESCC细胞的丁酰化修饰组学检测
2 HSP90 K754的丁酰化修饰导致肿瘤的化疗耐药性
质谱分析结果显示,HSP90蛋白存在4个丁酰化修饰位点,只有K754位点突变为精氨酸R时 (模拟不会发生丁酰化修饰) 才会显著抑制肿瘤耐药性。此外,HSP90 K754在非洲爪蟾到人的进化中高度保守,提示该位点的功能重要性。克隆实验以及肿瘤异种移植实验进一步证明了HSP90过表达会增加ESCC细胞对5-FU的抗性,而将K754突变为R754后,肿瘤细胞对5-FU耐药下降。为了探索这一表型背后的机制,研究人员通过点突变实验,发现HSP90 K754R显著破坏了HSP90蛋白的稳定性,促使其发生泛素化而降解。这表明K754丁酰化修饰对于维持HSP90蛋白稳定的重要性。因此,HSP90 K754的丁酰化修饰在ESCC化疗耐药中扮演了关键角色,可能通过维持HSP90的稳定性发挥功能。
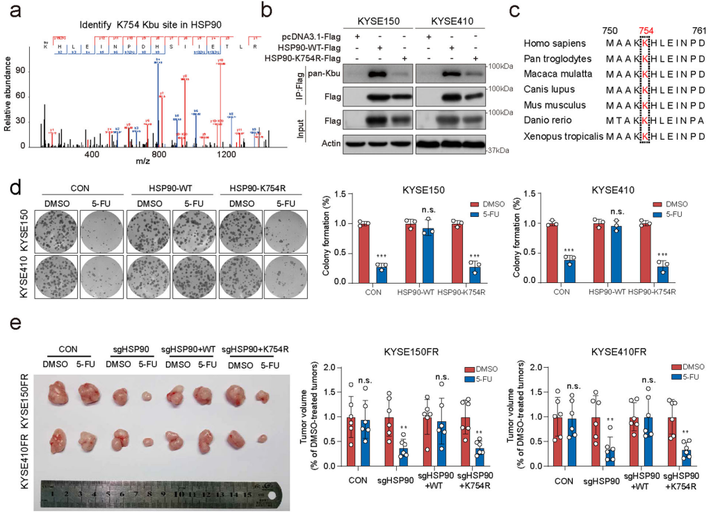
图2 HSP90 K754的丁酰化修饰导致肿瘤的化疗耐药性
3 SDCBP是HSP90丁酰化修饰的关键驱动因素
生化实验发现,KAT8在抗性细胞和亲代细胞之间的表达存在差异,但是HDAC11的表达则没有差异,因此研究人员推测可能存在其它蛋白质与HDAC11共同调节HSP90的丁酰化修饰和蛋白质稳定性(泛素化水平),也提示不同蛋白质翻译后修饰之间可能存在潜在关联。
为了鉴定HSP90的结合蛋白,研究人员将耐药的ESCC细胞系中的HSP90先进行免疫沉淀后联合质谱检测(IP-MS),并将所得到的数据与丁酰化修饰组学数据进行联合分析,鉴定到候选蛋白SDCBP。研究人员通过IP实验验证SDCBP与HSP90可以相互结合。且发现HSP90不影响SDCBP的稳定性,反而是SDCBP影响HSP90的稳定性。这些结果表明SDCBP是导致HSP90丁酰化和蛋白降解(泛素化水平)的重要因素。

图3 SDCBP是HSP90丁酰化修饰的关键驱动因素
SDCBP虽然与HDAC11竞争结合HSP90,但其在化疗耐药中的作用尚不清楚。体内外实验显示SDCBP的过表达增强了细胞对5-FU的耐药性,敲低SDCBP则影响了细胞的增殖和细胞活力。机制研究发现SDCBP的过表达激活了AKT信号通路,上调了TS蛋白的表达,从而引起ESCC化疗耐药。HSP90的敲低则逆转这些特征,提示HSP90受到SDCBP的调控,通过AKT信号通路和TS蛋白在5-FU的耐药性中发挥关键作用。研究进一步通过临床样本的IHC染色和生存曲线的分析,证实了SDCBP在临床样本化疗耐药中的重要作用。此外,该研究还通过高通量化合物药筛体系,筛选得到了靶向HSP90丁酰化的先导化合物 (V020-9974)。该化合物可降低HSP90与SDCBP的结合,从而抑制HSP90的丁酰化修饰水平,增强细胞对5-FU的敏感性。这些结果表明抑制HSP90丁酰化修饰是一种潜在的抗5-Fu耐药新策略,提示了新型酰化修饰是助力肿瘤精准医学领域的重要工具。
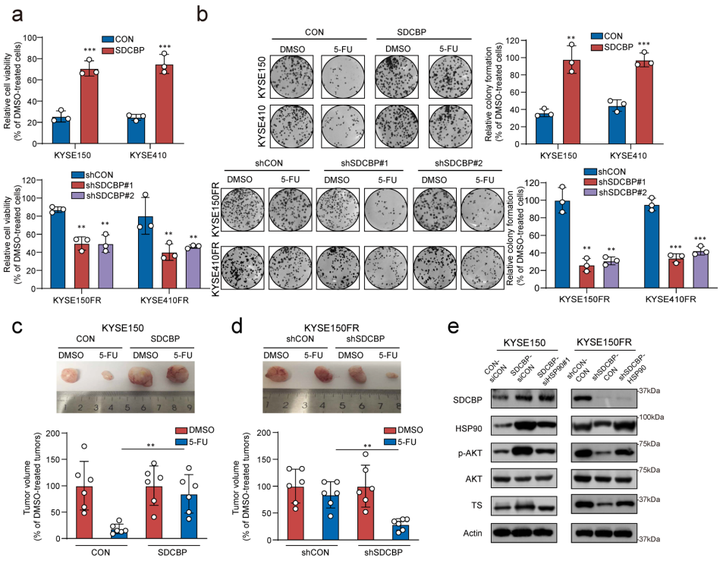
图4 SDCBP促进ESCC化疗耐药
综上所述,该研究首次对化疗耐药和化疗敏感的ESCC细胞的丁酰化修饰进行了系统分析,发现了调控肿瘤5-Fu耐药的关键因子:HSP90 K754位的丁酰化修饰。研究还发现SDCBP是驱动HSP90丁酰化修饰的关键因素,通过与HDAC11竞争性结合HSP90,导致HSP90丁酰化修饰水平上调,进一步维持了HSP90的稳定性。研究也通过高通量化合物药筛体系,筛选得到小分子化合物V020-9974。该化合物通过抑制SDCBP-HSP90的结合,从而降低HSP90丁酰化修饰水平,促使其发生泛素化而降解,诱导细胞化疗敏感性。该研究不仅开启了丁酰化修饰在癌症研究的新篇章,还为丁酰化修饰在化疗敏感/耐药中的研究提供了重要案例和宝贵资源。
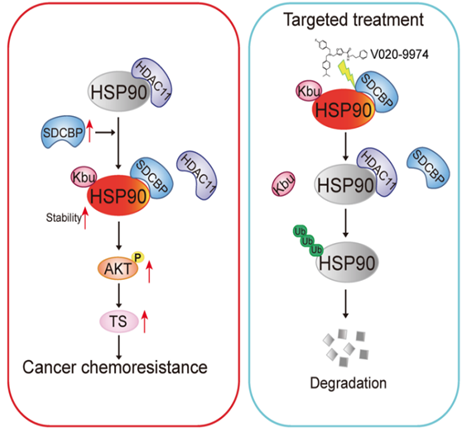
图5 研究机制图解
景杰生物致力于提供权威、专业的蛋白质组学及修饰组学科技服务。可提供乳酸化、巴豆酰化、琥珀酰化和丁酰化等多种新型酰化修饰,助力破译代谢研究“核心”密码。在新型酰化修饰组学研究中,景杰生物拥有高特异性的修饰类泛抗体;高分辨率、高灵敏度的质谱仪;经验丰富的蛋白质修饰组研究团队,可提供全面的解决方案,包括样品准备、新型酰化修饰分析和数据解读。之后将继续致力于创新研究和技术发展,推动新型酰化修饰组学在生物科学领域的应用和发展。
参考文献
1. Liao, Long, et al. 2023. Lysine 2-hydroxyisobutyrylation of NAT10 promotes cancer metastasis in an ac4C-dependent manner. Cell Research.2. Yan He, et al. 2023. Lysine butyrylation of HSP90 regulated by KAT8 and HDAC11 confers chemoresistance. Cell Discovery.
景杰生物作为修饰组学领域的领跑者,拥有多种修饰抗体和修饰组学质谱检测服务。如果您想了解相关产品和服务的更多信息,请扫描下方二维码填写合作咨询表单、或咨询景杰生物销售工程师、或拨打科服热线400-100-1145。如有转载、投稿等其他合作需求,请在文章下方留言,或添加微信ptm-market咨询。



 浙公网安备 33010602011771号
浙公网安备 33010602011771号