热力学基础
前言
其实是想直接开始写热力学基础的内容的,但是我发现这部分非常需要前置的气体动理论的支撑,因此先写完了气体动理论再开始写热力学基础相关内容。
鉴于这部分的内容量比较大,我也不打算再分多篇了,就直接一篇写到底吧。一次性肯定是搞不完的,就几天每天往后更一点点吧。就直接跟着参考PPT的顺序走了。
1.热力学第一定律
热力学第一定律主要讨论系统与外界的能量交换的关系。
系统与外界的能量交换分两种:做功和传热。做功是宏观上力的作用产生的结果,而传热是微观上分子热运动产生的结果。是两个完全不同的过程。
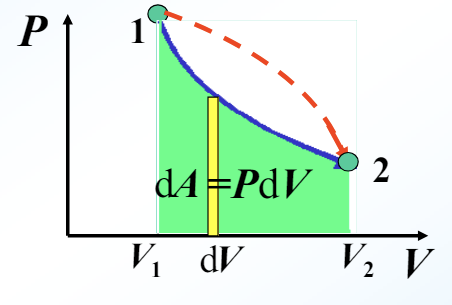
我们记系统从状态1演化到状态2的过程中:外界对系统做功为 \(A_外\) ;外界传给系统的热量为 \(Q\) ,系统初末状态的内能差为 \(\Delta E = E_2-E_1\) ,由能量守恒定律得
现在换一个角度,系统对外界做功就是 \(A=-A_外\) ,因此有
这就是热力学第一定律的表达式。
将其微分成无限小的过程则有
微元符号
注意到微分形式的热力学第一定律有两处取的是 \(\rm {đ}\) 而不是 \(\rm {d}\) ,这是因为,在数学上,全微分的定义是基于一个在该处可微的函数而定的,而此处, \(A\) 和 \(Q\) 均是与状态转移过程有关的物理量,无法写出一个只含状态参数的函数来表达,因此它们的微小量不符合全微分定义,这里的微小量只表示在特定过程下的微小变化量,记作微元符号 \(\rm{đ}\) 。
比较有意思的一点是,我找了很久的资料都没有记录markdown中微元符号的写法,所以最后不得已就直接用越南语的一个字母đ近似替代了。
强调一遍:\(Q\) 表示系统吸收的热量, \(\Delta E\) 表示系统内能增量, \(A\) 表示系统对外做的功。符号问题自行回到这里确认。
下面所有推导均是在准静态过程下进行的
这里用 \(A\) 来表达功而不用 \(W\) 应该是特指我们讨论的力的做功。根据功的定义我们可以做出如下推导
在\(P-V\)图上可以形象表示如下(后续图片均取自参考PPT,侵删)
2.理想气体的热容
热容量 \(C\) 的定义是物体温度升高 \(1K\) 所需要吸收的热量,单位为 \(J/K\) 。
根据定义可得 \(C=\frac{{\rm đ}Q}{{\rm d}T}\)
上式可以改写为 \({\rm đ}Q=C{\rm d}T\)
两边积分可得 \(Q=\int_{T_1}^{T_2}C{\rm d}T\)
热容量与系统的摩尔数和经历的过程有关。常用的有定压摩尔热容 \(C_{P,m}\) 和定容摩尔热容 \(C_{V,m}\) 。
从微观上推导理想气体的热容量
由理想气体内能公式 \(E=\frac i2 \nu RT\) 微分可得 \({\rm d}E=\frac i2\nu R{\rm d}T\)
因此经过一微小准静态过程后有
对于定容摩尔热容,有 \({\rm d}V =0\) ,因此 \({\rm đ}Q = {\rm d}E = \frac i2\nu R{\rm d}T\) 。因此
对于定压摩尔热容,\(P\) 为常量,因此关系式 \(PV=\nu RT\)微分得 \(P{\rm d}V=\nu R{\rm d}T\) 。因此
显然有关系式 \(C_P>C_V\)
引入比热比的概念: \(\gamma = \frac{C_P}{C_V}=\frac{i+2}{i}\)
3.理想气体四种过程的计算
1.等容过程
等容的特点是体积不变,因此 \({\rm d}V=0\) ,从而 \({\rm đ}A=0\)
因此有
等容过程中系统吸热全部用于增加内能。
2.等压过程
等压的特点是压强不变,即 \(P=C\) 。可以推得
可见两个过程中 \(\Delta E\) 的表达式相同,这与在气体动理论中所推导得的内能只与温度和物质的量有关而与过程无关是吻合的。
3.等温过程
特点是温度不变,即 \({\rm d}T=0\) ,从而内能不变, \(\Delta E=0\)
由此可以推得过程方程满足 \(PV=C\) ,因此
等温过程系统吸收的热量全部用于对外做功。
4.绝热过程
绝热过程的特点是系统不吸收热量,即 \({\rm đ}Q = 0\) ,此时 \({\rm đ}A = -{\rm d}E\) 。
气体在绝热状态下膨胀时内能减少。
从气体做功的公式直接推导与和内能变化公式的关系联立可推出绝热过程的过程方程
推导过程
积分可得 \(\ln P+\gamma\ln V=C_1\) ,或者写作 \(PV^{\gamma}=C_2\)
所以绝热过程满足过程方程 \(PV^{\gamma}=C\) ,结合 \(PV=\nu RT\)还可以推出更多方程,在此不一一列举。
与等温过程相比,绝热过程的过程方程中 \(\gamma>1\),因此直观来讲绝热线比等温线更陡。
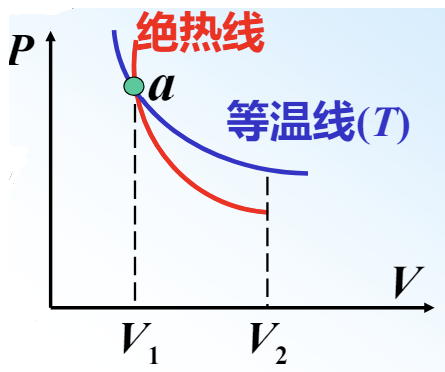
多方过程
将前面讲到的各种过程的过程方程进行总结可以得出,它们的形式一般是 \(PV^n=C\)。
这种过程称为多方过程,其中常数 \(n\) 称为多方指数。将前面提到的四个过程代回此式可得
循环过程
系统经历一系列变化又回到了初始状态的过程称为循环过程。系统中的工作物质称为工质。
将一个循环的状态转移过程绘制在 \(P-V\) 图上就可以得到一个闭合环。
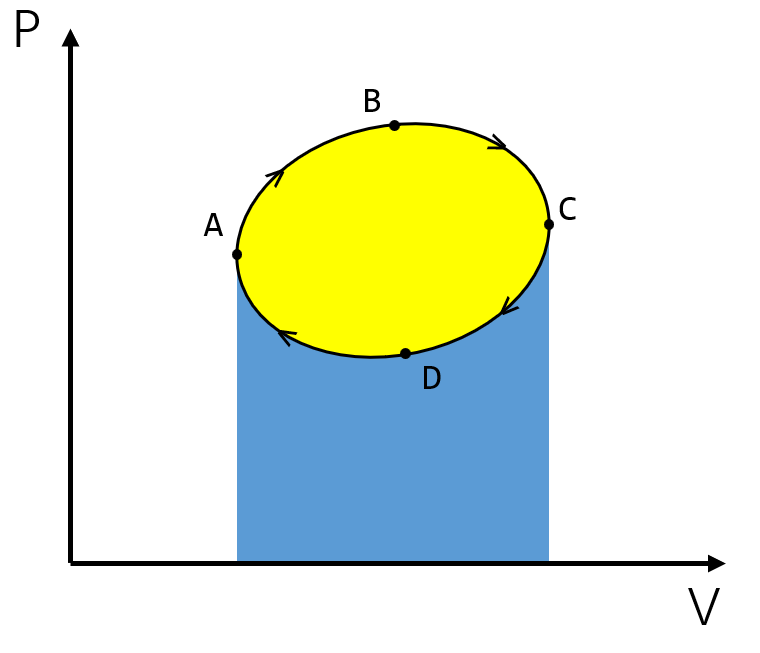
可见,正向过程 \(abc\) 的功 \(A_1\) 就是黄色面积和蓝色面积之和,逆向过程 \(cda\) 的功 \(A_2\) 是蓝色面积,正向过程系统对外界做功,逆向过程外界对系统做功。因此净功就是 \(A_净=A_1-A_2\) 。
以蒸汽机为例,画出循环过程示意图如下
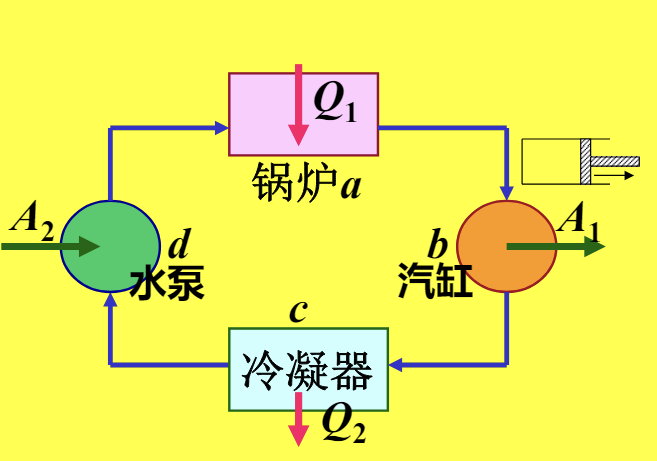
代入刚刚求得的净功表达式,就可以将热机理想模型化简为下图:
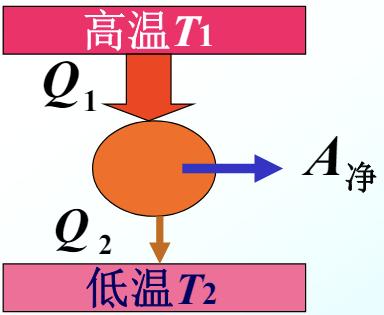
根据能量守恒定律,有 \(A_净 = Q_1- \mid Q_2 \mid\) ,这里取绝对值避免符号问题。
那么热机总效率就是
例:空气标准奥托循环的效率(帅OTTO)
奥托循环是四冲程内燃机进行的循环过程,由两条等容线和两条绝热线组成。
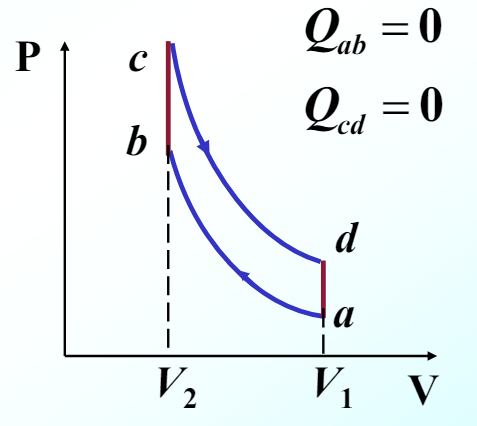
第一步,绝热压缩 \(a\to b\) ,气体从 \(V_1\to V_2\) (由于过程很迅速,与内燃机活塞缸体的热交换可忽略,故为绝热过程)
第二步,压缩后的油气混合物爆燃,工质等容吸热 \(b\to c\) ,气体状态 \((V_2,T_2)\to (V_2,T_3)\)(由于飞轮处于最顶端位置,体积变化率小,而爆燃速度很快,可忽略过程中体积变化,故为等容过程)
\(Q_1=\nu C_V(T_3-T_2)\)
第三步,爆燃气体绝热膨胀 \(c\to d\),气体对外做功,\(V_2\to V_1\)。(视为绝热同第一步)
第四步,高温气体等容放热 \(d\to a\),气体状态 \(T_4\to T_1\)
\(Q_1=\nu C_V(T_1-T_4)\)
因此,奥托循环的效率为 \(\eta_{奥托}=1-\frac{\mid Q_2\mid}{Q_1}=1-\frac{T_4-T_1}{T_3-T_2}\)
到这一步式子还不够简洁,考虑求四个状态下温度的关系来进一步化简。
利用绝热过程的过程方程 \(TV^{\gamma-1}=C\) 可得
其中, \(r\) 表示压缩前后的体积比。通过化简表达式可得,在工质种类不变的情况下,热机效率只与体积比有关,且 \(r\ ↑,\eta ↓\) 。



 浙公网安备 33010602011771号
浙公网安备 33010602011771号