高亲和力+低背景!揭秘诊断级单抗的筛选秘诀
单克隆抗体(Monoclonal Antibody,简称mAb)作为一种高特异性、高亲和力的生物大分子,已经在临床诊断、治疗及科研领域中发挥了举足轻重的作用。特别是在诊断领域,单抗因其独特的靶向性和高灵敏度,成为了许多疾病标志物检测、免疫组织化学分析以及其他生物医学技术中的重要工具。对于单抗的筛选,尤其是高亲和力和低背景的单抗筛选,是确保其在诊断应用中获得优异表现的关键。
一、高亲和力单抗的筛选
亲和力(Affinity)是指抗体与抗原之间结合的紧密程度,通常用解离常数(KD)来量化。高亲和力的单抗能够在低浓度下与抗原特异性结合,具有较高的敏感性和较低的检测限,这对于诊断领域尤为重要。尤其是在检测微量病理标志物、细胞表面受体或血清中特定抗体时,单抗的高亲和力能够显著提高检测的精确性与可靠性。
1、筛选高亲和力单抗的方法:
(1)噬菌体展示技术(Phage Display)
噬菌体展示技术是一种强有力的单抗筛选技术。通过将抗体基因库装载到噬菌体的外壳上,可以在体外环境中筛选出与特定抗原结合能力最强的抗体。此技术通过多轮筛选(panning)不断优化抗体的亲和力,在实际应用中已经得到广泛的应用。
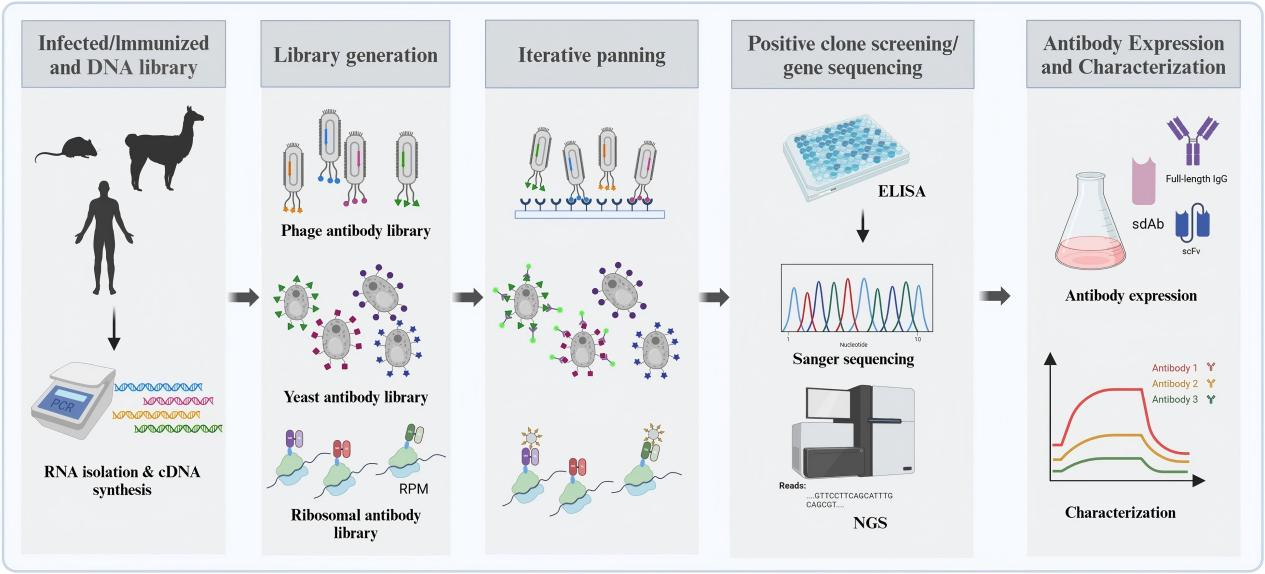
(2)酶联免疫吸附法(ELISA)
酶联免疫吸附法是通过抗体和抗原之间的结合反应产生颜色变化,从而检测结合亲和力。通过逐步调整实验条件和抗体浓度,可以挑选出具有高亲和力的单抗。

(3)表面等离子共振(SPR)
表面等离子共振是一种实时监测分子间相互作用的技术。通过在金属表面固定抗原或抗体,监测抗原-抗体结合过程中的光学变化,可以精确测定抗体的亲和力和解离常数(KD)。与传统的ELISA等方法相比,SPR能提供更为精准的亲和力数据。

2、高亲和力单抗的优化方法:
(1)体外亲和力成熟(Affinity Maturation)
体外亲和力成熟是一种通过引入突变(例如通过错误引导DNA聚合酶)增加抗体变异率,从而增强亲和力的技术。此技术通过逐步筛选和优化,最终获得具有极高亲和力的单抗。
(2)优化抗体表达系统
抗体的表达系统对最终的亲和力和特异性也有重要影响。使用高效的表达系统,如CHO细胞(中国仓鼠卵巢细胞)或HEK293细胞,可以提高抗体的产量和质量,从而间接提高亲和力。
二、低背景的单抗筛选
在免疫检测中,背景信号是指除了目标抗原外,抗体与其他非目标分子(如非特异性蛋白、杂质或不相关细胞表面抗原)产生的非特异性结合。背景信号的存在会导致假阳性结果,影响诊断准确性。因此,筛选出低背景的单抗对于提高检测的特异性至关重要。
低背景单抗筛选的策略:
(1)抗体修饰
为减少背景信号,常常对抗体进行化学修饰,例如通过改变抗体的糖基化模式,增强其与目标抗原的亲和力而减少与其他分子的非特异性结合。此外,使用不同的标签或辅因子(如生物素、荧光团、酶等)也可以通过提高信号与非特异性结合的分离度,从而降低背景。
(2)预吸附技术
预吸附技术是指在进行抗体检测之前,将抗体与某些非目标分子进行预先结合(如与动物血清、细胞蛋白或无关抗原结合)。这一步骤能够去除抗体中的杂质,减少与非目标分子的结合,从而降低背景信号。
(3)优化检测体系
优化免疫检测体系,合理选择二抗、免疫标记物、缓冲液等,也是降低背景信号的有效途径。例如,使用适当的二抗(例如亲和力较强的羊抗鼠IgG)和优化缓冲液的组成,可以减少抗体与其他分子的非特异性结合。
三、高亲和力与低背景的平衡
在实际应用中,如何平衡高亲和力与低背景是单抗筛选中的一大挑战。通常情况下,高亲和力的抗体可能会增加与非目标分子的非特异性结合,导致背景信号的上升。为了避免这种情况,科研人员需要在筛选过程中谨慎选择合适的抗体亲和力和筛选策略,以确保抗体在诊断中的最佳表现。
- 多轮筛选:通过多轮筛选和优化,逐步提高抗体的亲和力,同时在每一轮中控制非特异性结合,从而确保高亲和力与低背景的平衡。
- 抗体库设计:设计高质量的抗体库,并进行精准的筛选。通过引入特定的筛选条件和筛选标靶,确保抗体能够在高亲和力和低背景之间取得平衡。
- 分子工程:通过对抗体进行分子工程修改,如改变可变区的氨基酸序列或通过人源化技术,减少与非目标分子的结合,优化抗体性能。
随着单抗技术的发展,尤其是高通量筛选和精确化学修饰技术的不断进步,未来筛选出既高亲和力又低背景的单抗将变得更加高效和精确。人工智能、基因工程和结构生物学的结合将为单抗筛选提供更为先进的工具,使得高亲和力和低背景单抗的筛选不再是一个难题。
参考文献
- Winter, G., & Griffiths, A. D. (1994). "The human antibody repertoire." Nature, 368(6476), 702-703.
- Barbas, C. F., & Burton, D. R. (2009). Phage Display: A Laboratory Manual. Cold Spring Harbor Laboratory Press.
- Zha, J., & Zhang, W. (2017). "High-affinity monoclonal antibodies: Advances and challenges." Journal of Immunological Methods, 438, 29-35.
- Lushbaugh, C. C., & Clancy, K. W. (2014). "Improving the specificity of monoclonal antibodies in diagnostic applications." Clinical Immunology, 153(3), 147-157.
- Sanz, I., & Lee, D. (2018). "Engineering monoclonal antibodies for high affinity and specificity." Trends in Immunology, 39(10), 890-902.


 浙公网安备 33010602011771号
浙公网安备 33010602011771号