氧族元素
一、氧
元素名称:氧。
元素符号:O。
原子序数:8。
在周期表中的位置:第二周期ⅥA族。
电子排布式:[He]2s22p4。
丰度:1。
1.氧气
化学式:O2。
分类:非金属单质。
物理性质:无色无味气体,密度大于空气(空气:1.293g/L,氧气:1.429g/L),不易溶于水,熔点:-218℃,沸点:-183℃。液氧:淡蓝色液体。固氧:淡蓝色雪花状固体。
化学性质:
①非金属单质的通性:
与金属单质反应。
与非金属单质反应。
②氧化性。
制备:
工业制氧气:分离液态空气。
实验室制氧气:
高锰酸钾制氧气:2KMnO4 =△= K2MnO4 + MnO2 + O2↑。
氯酸钾制氧气:2KClO3 =MnO2=△= 2KCl + 3O2↑。
过氧化氢制氧气:2H2O2 =MnO2= 2H2O + O2↑。
顺磁性。
2.臭氧
化学式:O3(3个O:sp2杂化,π34)。
路易斯结构式: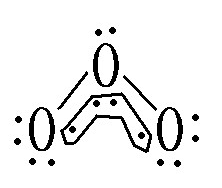 。
。
分类:非金属单质。
物理性质:淡蓝色具有鱼腥味气体,密度大于空气,能溶于水。液态臭氧:深蓝色液体。固态臭氧:蓝黑色固体。
化学性质:
①氧化性:
与银单质反应:2Ag + 2O3 = Ag2O2 + 2O2。
与碘离子反应:O3 + 2I- + H2O = I2 + O2 + 2OH-(测定臭氧的含量)。
与氰根离子反应:O3 + CN- = OCN- + O2。
②不稳定性:2O3 = 3O2。
3.过氧化氢
过氧化氢的水溶液:俗名:双氧水。
化学式:H2O2(2个O:sp3杂化)。
结构式: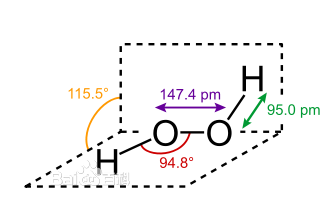 。
。
分类:弱酸。
物理性质:淡蓝色粘稠液体,密度大于水,能以任意比例与水互溶。
化学性质:
①酸性:
电离方程式:H2O2 ⇌ H+ + HO2-。HO2- ⇌ H+ + O22-。
与碱反应:H2O2 + 2OH- = O22- + 2H2O。
酸性:HCN > H2O2 > H2O。
②氧化性:
与溴离子反应:H2O2 + 2Br- + 2H+ = Br2 + 2H2O。
与亚铁离子反应:H2O2 + 2Fe2+ + 2H+ = 2Fe3+ + 2H2O。
与碘离子反应:H2O2 + 2I- + 2H+ = I2 + 2H2O。
与亚硫酸反应:H2O2 + H2SO3 = H2SO4 + H2O。
与亚铬酸根离子反应:3H2O2 + 2CrO2- + 2OH- = 2CrO42- + 4H2O。
与氢氧化锰反应:Mn(OH)2 + H2O2 = MnO2 + 2H2O。
与硫化铅反应:PbS + 4H2O2 = PbSO4 + 4H2O。
③还原性:
与氯气反应:Cl2 + H2O2 = 2Cl- + O2 + 2H+(工业除氯气)。
与高锰酸根离子反应:5H2O2 + 2MnO4- + 6H+ = 2Mn2+ + 5O2↑ + 8H2O。3H2O2 + 2MnO4- = 2MnO2 + 3O2↑ + 2OH- + 2H2O。
④不稳定性:2H2O2 =△/催化剂= 2H2O + O2↑(催化剂:Cr3+、Cr2O72-、Fe2+、Fe3+、Mn2+、MnO2、Cu2+、Ag+)。
制备:
工业制过氧化氢:
①电解(饱和硫酸氢铵溶液)法:
2NH4HSO4 =通电= (NH4)2S2O8(阳极产物) + H2↑(阴极产物)。
(NH4)2S2O8 + 2H2O =通电= 2NH4HSO4 + H2O2。
②乙基蒽醌法:H2 + O2 =2-乙基蒽醌=Pd= H2O2。
二、硫
元素名称:硫。
元素符号:S。
原子序数:16。
在周期表中的位置:第三周期ⅥA族。
电子排布式:[Ne]3s23p4。
1.硫单质
化学式:S(S2、S4、S6、S8(最稳定))。
结构式: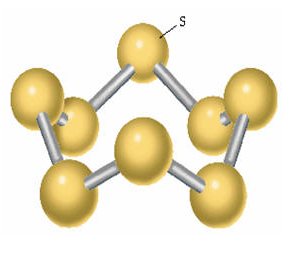 。
。
同素异形体:单斜硫、斜方硫(正交硫)。
分类:非金属单质。
物理性质:淡黄色固体,密度大于水,难溶于水,微溶于乙醇,易溶于苯、二硫化碳,硬而脆,熔点低,沸点低。
化学性质:
①非金属单质的通性:
与金属单质反应:
与钠单质反应:2Na + S =研磨/点燃/△= Na2S。
与铁单质反应:Fe + S =点燃/△= FeS。
与铜单质反应:2Cu + S =△= Cu2S。
与汞单质反应:Hg + S = HgS。
与银单质反应:2Ag + S =摩擦/△= Ag2S。
与非金属单质反应:
与氧气反应:S + O2 =点燃= SO2。
与氢气反应:H2 + S =△= H2S。
与碱反应:
3S + 6NaOH =△= 2Na2S + Na2SO3 + 3H2O。
②还原性:
与浓硫酸反应:S + 2H2SO4(浓) =△= 3SO2↑ + 2H2O。
与浓硝酸反应:S + 6HNO3(浓) =△= H2SO4 + 6NO2↑ + 2H2O。
③与连多硫酸反应:yS + H2SxO6 = H2Sx+yO6。
④与硫化钠反应:(x-1)S + Na2S = Na2Sx。
⑤与多硫化钠反应:yS + Na2Sx = Na2Sx+y。
⑥与亚硫酸钠反应:S + Na2SO3 = Na2S2O3。
二氧化硫
化学式:SO2。(S:sp2杂化,π34)
结构式: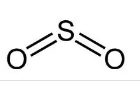 。
。
分类:酸性氧化物。
物理性质:无色具有刺激性气味有毒气体,密度大于空气,易溶于水(1:40)。
化学性质:
①酸性氧化物的通性:
与水反应:H2O + SO2 ⇌ H2SO3。
与碱性氧化物反应:
与氧化钠反应:Na2O + SO2 = Na2SO3。
与氧化钙反应:CaO + SO2 = CaSO3。
与碱反应:SO2(少量) + 2OH- = SO32- + H2O。SO2(足量) + OH- = HSO3-。
与氢氧化钠反应:SO2(少量) + 2NaOH = Na2SO3 + H2O。SO2(足量) + NaOH = NaHSO3。
与氢氧化钙反应:SO2(少量) + Ca(OH)2 = CaSO3↓ + H2O。2SO2(足量) + Ca(OH)2 = Ca(HSO3)2。
②还原性:
与氧气反应:2SO2 + O2 ⇌V2O5⇌△⇌ 2SO3。
与氯气反应:Cl2 + SO2 + 2H2O = 2HCl + H2SO4。
与过氧化氢反应:H2O2 + SO2 = H2SO4。
与溴单质反应:Br2 + SO2 + 2H2O = 2HBr + H2SO4。
与铁离子反应:2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+。
与碘单质反应:I2 + SO2 + 2H2O = 2HI + H2SO4。
与稀硝酸反应:3SO2 + 2HNO3(稀) + 2H2O = 3H2SO4 + 2NO。
与浓硝酸反应:SO2 + 2HNO3(浓) = H2SO4 + 2NO2。
与高锰酸根离子反应:5SO2 + 2MnO4- + 2H2O = 2Mn2+ + 5SO42- + 2H+。
③氧化性:
与硫化氢反应:SO2 + 2H2S = 3S↓ + 2H2O。
④漂白性(暂时性漂白/化合型漂白):
品红溶液遇二氧化硫褪色(加热后红色恢复)。
制备:
工业制二氧化硫:
S + O2 =点燃= SO2 / 4FeS2 + 11O2 =高温= 2Fe2O3 + 8SO2 / 3FeS2 + 8O2 =高温= Fe3O4 + 6SO2。
实验室制二氧化硫:Na2SO3 + H2SO4(浓) =△= Na2SO4 + H2O + SO2↑。
三氧化硫
化学式:SO3(固态三氧化硫:石棉形(链状)((SO3)n):S:sp3杂化,SO4四面体;三聚体(环状)((SO3)3):S:sp3杂化。气态三氧化硫:平面三角形(SO3):S:sp2杂化,π46)。
结构式: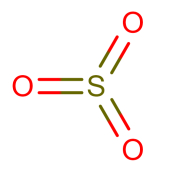 。
。
分类:酸性氧化物。
物理性质:无色具有刺激性气味针状固体/无色具有刺激性气味液体/无色具有刺激性气味气体,密度大于空气,易溶于水。
化学性质:
①酸性氧化物的通性:
与水反应:H2O + SO3 = H2SO4。
与碱性氧化物反应:
与氧化钠反应:Na2O + SO3 = Na2SO4。
与氧化钙反应:CaO + SO3 = CaSO4。
与碱反应:SO3 + 2OH- = SO42- + H2O。
与氢氧化钠反应:SO3 + 2NaOH = Na2SO4 + H2O。
与氢氧化钙反应:SO3 + Ca(OH)2 = CaSO4 + H2O。
②氧化性:
与锌单质反应:Zn + SO3 =高温= ZnO + SO2。
与铁单质反应:2Fe + 3SO3 =高温= Fe2O3 + 3SO2。
与磷单质反应:2P + 5SO3 =高温= P2O5 + 5SO2。
与溴化氢反应:SO3 + 2HBr =高温= Br2 + SO2 + H2O。
与碘化氢反应:SO3 + 2HI =高温= I2 + SO2 + H2O。
③与浓硫酸反应:H2SO4 + SO3 = H2S2O7。
制备:
工业制三氧化硫:2SO2 + O2 ⇌V2O5⇌△⇌ 2SO3。
亚硫酸
化学式:H2SO3。
结构式: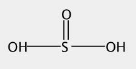 。
。
分类:中强酸。
化学性质:
①酸性:
电离方程式:H2SO3 ⇌ H+ + HSO3-。HSO3- ⇌ H+ + SO32-。
②还原性。
③氧化性。
④不稳定性:H2SO3 = H2O + SO2↑。
(浓)硫酸
俗名:坏水。
化学式:H2SO4。
结构式: 。
。
分类:强酸。
物理性质:无色无味黏稠油状液体,密度大于水,能以任意比例与水互溶,溶于水放出大量的热,吸水性。
化学性质:
①酸性:
电离方程式:H2SO4 = H+ + HSO4-。HSO4- = H+ + SO42-。
与金属单质反应。
与金属氧化物反应。
与碱反应:H+ + OH- = H2O。
与氢氧化钠反应:H2SO4 + 2NaOH = Na2SO4 + 2H2O。
与氢氧化钙反应:H2SO4 + Ca(OH)2 = CaSO4 + 2H2O。
与盐反应:CaF2 + H2SO4(浓) =△= CaSO4 + 2HF↑。2NaCl + H2SO4(浓) =△= Na2SO4 + 2HCl↑。2NaNO3 + H2SO4(浓) =△= Na2SO4 + 2HNO3↑。
②氧化性:
与铜单质反应:Cu + 2H2SO4(浓) =△= CuSO4 + SO2↑ + 2H2O。
与碳单质反应:C + 2H2SO4(浓) =△= CO2↑ + 2SO2↑ + 2H2O。
与硫单质反应:S + 2H2SO4(浓) =△= 3SO2↑ + 2H2O。
与硫化氢反应:H2S + H2SO4(浓) = S↓ + SO2↑ + 2H2O。
与硫酸亚铁反应:2FeSO4 + 2H2SO4(浓) = Fe2(SO4)3 + SO2↑ + 2H2O。
铝、铁、铬遇冷的浓硫酸发生钝化。
③吸水性:
与五水硫酸铜反应:CuSO4·5H2O =浓H2SO4= CuSO4 + 5H2O。
④脱水性:
与蔗糖反应:C12H22O11 =浓H2SO4= 12C + 11H2O。
⑤与三氧化硫反应:H2SO4 + SO3 = H2S2O7。
硫化氢
俗名:氢硫酸(硫化氢的水溶液)。
化学式:H2S。
分类:弱酸。
物理性质:无色具有臭鸡蛋气味有毒气体,密度大于空气,能溶于水(1:2.6)。
化学性质:
①酸性:
电离方程式:H2S ⇌ H+ + HS-。HS- ⇌ H+ + S2-。
与碱反应:H2S(少量) + 2OH- = S2- + 2H2O。H2S(足量) + OH- = HS- + H2O。
与氢氧化钠反应:H2S(少量) + 2NaOH = Na2S + 2H2O。H2S(足量) + NaOH = NaHS + H2O。
与氢氧化钙反应:H2S(少量) + Ca(OH)2 = CaS + 2H2O。2H2S(足量) + Ca(OH)2 = Ca(HS)2 + 2H2O。
②还原性:
与氧气反应:2H2S + O2 = 2S↓ + 2H2O。2H2S + O2(少量) =点燃= 2S + 2H2O。2H2S + 3O2(足量) == 2SO2 + 2H2O。
与氯气反应:Cl2 + H2S = S↓ + 2HCl。
与溴单质反应:Br2 + H2S = S↓ + 2HBr。
与铁离子反应:2Fe3+ + H2S = S↓ + 2Fe2+ + 2H+。
与碘单质反应:I2 + H2S = S↓ + 2HI。
与二氧化硫反应:SO2 + 2H2S = 3S↓ + 2H2O。
制备:FeS + H2SO4 = FeSO4 + H2S↑。
硫代硫酸
化学式:H2S2O3。
结构式: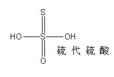 。
。
分类:弱酸。
化学性质:
①酸性。
②还原性。
③氧化性。
④不稳定性:H2S2O3 = S↓ + SO2↑ + H2O。
连二亚硫酸
化学式:H2S2O4。
结构式: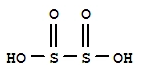 。
。
分类:弱酸。
①酸性。
②还原性。
③氧化性。
④不稳定性。
过一硫酸(过氧化氢的一磺酸基取代物)
俗名:卡罗酸。
化学式:H2SO5。
结构式: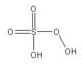 。
。
分类:(一元)强酸。
化学性质:
①酸性。
②氧化性。
③不稳定性。
制备:
H2O2 + H2SO4 = H2SO5 + H2O。
H2O2 + ClSO3H = H2SO5 + HCl。
焦亚硫酸
化学式:H2S2O5。
结构式: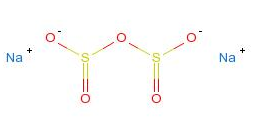 。
。
分类:弱酸。
化学性质:
①酸性。
②还原性。
③氧化性。
④热不稳定性。
⑤与水反应。
连多硫酸
化学式:H2SxO6(x = 2,3,4,5,6)。
结构式: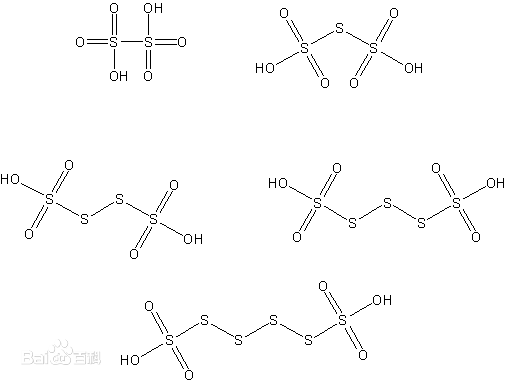 。
。
分类:强酸。
化学性质:
①酸性。
②还原性。
③氧化性。
④不稳定性:H2SxO6 =△= H2SO4 + SO2↑ + (x-2)S↓。
⑤与硫单质反应(除连二硫酸):H2SxO6 + yS = H2Sx+yO6。
焦硫酸
化学式:H2S2O7。
结构式: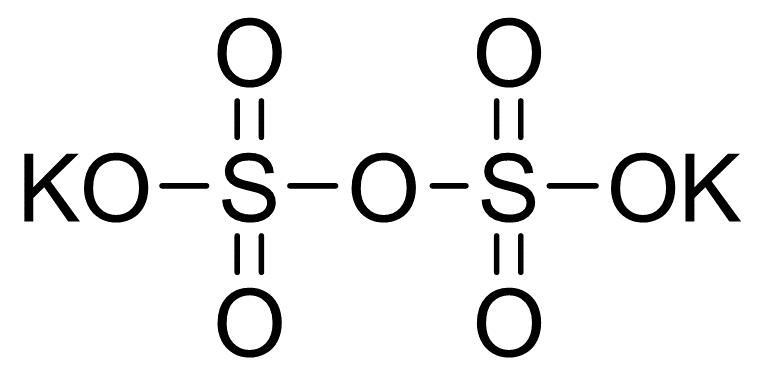 。
。
分类:强酸。
化学性质:
①酸性。
②氧化性。
③热不稳定性:H2S2O7 =△= H2SO4 + SO3↑。
④与水反应:H2S2O7 + H2O = 2H2SO4。
制备:H2SO4 + SO3 = H2S2O7。
过二硫酸(过氧化氢的二磺酸基取代物)
化学式:H2S2O8。
结构式: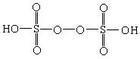 。
。
分类:强酸。
化学性质:
①酸性。
②氧化性。
③不稳定性。
制备:2H2SO4 =通电= H2S2O8(阳极产物) + H2↑(阴极产物)。
硫化物
物理性质:
硫化锰:肉色固体,难溶于水,易溶于稀盐酸。
硫化亚铁:黑色固体,难溶于水,易溶于稀盐酸。
硫化钴:黑色固体,难溶于水,易溶于稀盐酸。
硫化镍:黑色固体,难溶于水,易溶于稀盐酸。
硫化锌:白色固体,难溶于水,易溶于稀盐酸。
硫化镉:黄色固体,难溶于稀盐酸,易溶于浓盐酸。
三硫化二锑:橙色固体,难溶于稀盐酸,易溶于浓盐酸。
五硫化二锑:橙色固体,难溶于稀盐酸,易溶于浓盐酸。
三硫化二铋:暗棕色固体,难溶于稀盐酸,易溶于浓盐酸。
硫化亚锡:褐色固体,难溶于稀盐酸,易溶于浓盐酸。
硫化锡:黄色固体,难溶于稀盐酸,易溶于浓盐酸。
硫化铅:黑色固体,难溶于稀盐酸,易溶于浓盐酸。
硫化亚铜:黑色固体,难溶于浓盐酸,易溶于浓硝酸。
硫化铜:黑色固体,难溶于浓盐酸,易溶于浓硝酸。
硫化银:黑色固体,难溶于浓盐酸,易溶于浓硝酸。
三硫化二砷:浅黄色固体,难溶于浓盐酸,易溶于浓硝酸。
五硫化二砷:浅黄色固体,难溶于浓盐酸,易溶于浓硝酸。
硫化亚汞:黑色固体,难溶于浓硝酸,易溶于王水。
硫化汞:黑色固体,难溶于浓硝酸,易溶于王水。
化学性质:
①盐的通性。
与酸反应:H+(少量) + S2- = HS-。2H+(足量) + S2- = H2S↑。
与盐反应。
②还原性。
③水解反应:
S2- + H2O = HS- + OH-。
HS- + H2O = H2S + OH-。
④与硫单质反应:(x-1)S + S2- = Sx2-(x = 2,3,4,5,6)。
多硫化物
物理性质:黄色 -> 橙色 -> 红色(x越大,颜色越深)。
化学性质:
①盐的通性:
与酸反应:2H+ + Sx2- = (x-1)S↓ + H2S↑。
②氧化性:
与硫化亚锡反应:Na2S2 + SnS = Na2SnS3。
③还原性。
④与硫单质反应:yS + Sx2- = Sx+y2-。
硫氢化物
化学性质:
①盐的通性:
与酸反应:H+ + HS- = H2S↑。
与碱反应:HS- + OH- = S2- + H2O。
②还原性。
③水解反应:HS- + H2O = H2S + OH-。
④热不稳定性。
亚硫酸盐
化学性质:
①盐的通性:
与酸反应:
H+(少量) + SO32- = HSO3-。
2H+(足量) + SO32- = H2O + SO2↑。
与盐反应:
与钙离子反应:Ca2+ + SO32- = CaSO3↓。
与钡离子反应:Ba2+ + SO32- = BaSO3↓。
②还原性。
③氧化性。
④水解反应:SO32- + H2O = HSO3- + OH-。HSO3- + H2O = H2SO3 + OH-。
⑤热不稳定性:4Na2SO3 =△= Na2S + 3Na2SO4。
⑥与硫单质反应:S + Na2SO3 =△= Na2S2O3。
亚硫酸氢盐
化学性质:
①盐的通性:
与酸反应:H+ + HSO3- = H2O + SO2↑。
与碱反应:HSO3- + OH- = SO32- + H2O。
②还原性。
③氧化性。
④水解反应:HSO3- + H2O = H2SO3 + OH-。
⑤热不稳定性:
亚硫酸氢钠受热分解:2NaHSO3 =△= Na2SO3 + H2O + SO2↑。
硫酸盐
化学式:
MⅠ2SO4·MⅡSO4·6H2O。例:六水合硫酸亚铁铵(摩尔盐):(NH4)2SO4·FeSO4·6H2O = (NH4)2Fe(SO4)2·6H2O。六水合硫酸镍铵:(NH4)2SO4·NiSO4·6H2O = (NH4)2Ni(SO4)2·6H2O(难溶于水)。
MⅠ2SO4·MⅢ2(SO4)3·24H2O。例:十二水合硫酸铝钾(明矾):K2SO4·Al2(SO4)3·24H2O = KAl(SO4)2·12H2O。
化学性质:
①盐的通性:
与盐反应:
与钙离子反应:Ca2+ + SO42- = CaSO4(微溶于水)。
与锶离子反应:Sr2+ + SO42- = SrSO4(微溶于水)。
与钡离子反应:Ba2+ + SO42- = BaSO4↓(难溶于水)。
与铅离子反应:Pb2+ + SO42- = PbSO4↓(微溶于水)。
与银离子反应:2Ag+ + SO42- = Ag2SO4(微溶于水)。
②氧化性。
③热不稳定性:
硫酸镁受热分解:MgSO4 =高温= MgO + SO3↑。
硫酸铝受热分解:Al2(SO4)3 =高温= Al2O3 + 3SO3↑。
硫酸铁受热分解:Fe2(SO4)3 =高温= Fe2O3 + 3SO3↑。
硫酸铅受热分解:PbSO4 =高温= PbO + SO3↑。
硫酸铜受热分解:CuSO4 =高温= CuO + SO3↑。
硫酸银受热分解:2Ag2SO4 =△= 4Ag + O2↑ + 2SO3↑。
硫酸氢盐
化学性质:
①盐的通性。
与碱反应:H+ + OH- = H2O。
与盐反应。
②氧化性。
③热不稳定性。
硫代硫酸盐
化学性质:
①盐的通性:
与酸反应:2H+ + S2O32- = S↓ + SO2↑ + H2O。
②还原性:
与氯气反应:4Cl2 + S2O32- + 5H2O = 8Cl- + 2SO42- + 10H+。
与碘单质反应:I2 + 2S2O32- = S4O62- + 2I-。
与氰根离子反应:S2O32- + CN- = SO32- + SCN-。
③氧化性。
④水解反应。
⑤配位性:
与氯化银反应:AgCl + 2S2O32- = [Ag(S2O3)2]3- + Cl-。
与溴化银反应:AgBr + 2S2O32- = [Ag(S2O3)2]3- + Br-。
制备:
S + Na2SO3 =△= Na2S2O3。
4SO2 + 2Na2S + Na2CO3 =△= 3Na2S2O3 + CO2。
连二亚硫酸盐
俗名:保险粉(连二亚硫酸钠)。
化学性质:
①盐的通性。
②还原性:
与氧气反应:
2Na2S2O4 + O2 + 2H2O = 4NaHSO3(气体分析中吸收氧气)。
Na2S2O4 + O2 + H2O = NaHSO3 + NaHSO4(气体分析中吸收氧气)。
③氧化性。
④水解反应。
⑤热不稳定性:
连二亚硫酸钠受热分解:2Na2S2O4 =△= Na2S2O3 + Na2SO3 + SO2↑。
制备:Zn + 2NaHSO3 = Zn(OH)2 + Na2S2O4。
过一硫酸盐
化学性质:
①盐的通性。
②氧化性。
③热不稳定性。
焦亚硫酸盐
化学性质:
①盐的通性。
②还原性。
③氧化性。
④热不稳定性。
⑤与水反应。
连多硫酸盐
化学性质:
①盐的通性。
②还原性。
③氧化性。
④热不稳定性。
⑤与硫单质反应。
焦硫酸盐
化学性质:
①盐的通性。
②氧化性。
③热不稳定性:Na2S2O7 =△= Na2SO4 + SO3↑。
④与水反应。
⑤与金属氧化物反应:
与氧化铝反应:Al2O3 + 3Na2S2O7 =高温= Al2(SO4)3 + 3Na2SO4。
与氧化铁反应:Fe2O3 + 3Na2S2O7 =高温= Fe2(SO4)3 + 3Na2SO4。
制备:
2NaHSO4 =△= Na2S2O7 + H2O。
过二硫酸盐
化学性质:
①盐的通性。
②氧化性:
与铜单质反应:Cu + S2O82- = Cu2+ + 2SO42-。
与铬离子反应:2Cr3+ + 3S2O82- + 7H2O = Cr2O72- + 6SO42- + 14H+。
与锰离子反应:2Mn2+ + 5S2O82- + 8H2O = 2MnO4- + 10SO42- + 16H+。
③热不稳定性:2Na2S2O8 =△= 2Na2SO4 + 2SO3↑ + O2↑。
制备:2NH4HSO4 =通电= (NH4)2S2O8(阳极产物) + H2↑(阴极产物)。
本文来自博客园,作者:临化银,转载请注明原文链接:https://www.cnblogs.com/luotei/p/15168516.html
——蘸以清墨,书我弦歌。

 浙公网安备 33010602011771号
浙公网安备 33010602011771号