文献阅读 | The FLC Locus: A Platform for Discoveries in Epigenetics and Adaptation
Whittaker, C., & Dean, C. (2017). The FLC locus: a platform for discoveries in epigenetics and adaptation. Annual Review of Cell and Developmental Biology, 33, 555-575.
作为一篇综述,本文通过FLC基因介绍了植物通过表观遗传适应环境的故事。
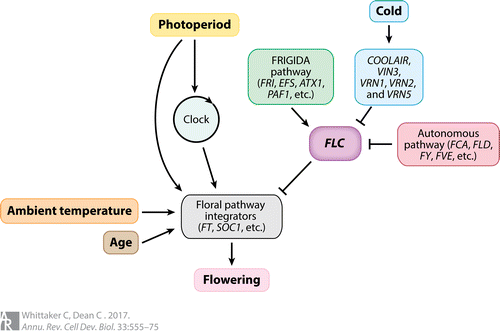
FLC 基因编码了可以防止开花的 MADS-box 转录因子,进而抑制了一系列开花启动基因(activators)如 FLOWERING LOCUS T (FT) 和 SUPPRESSOR OF CO (SOC1)。正因这一抑制作用,开花通常需要先降低FLC表达,进而有效激活 FT 以诱导开花。其他温度胁迫也可能通过 FLC 起作用:短期冷胁迫诱导 FLC 表达,并且升高的环境温度会抑制 FLC 表达,波动的温度在 FLC 处具有复杂的结果。
FLC 在整合多个不同植物谱系的温度响应方面起着保守的作用,但是,不同物种之间和内部的春化要求存在很大差异。对春化需要的多样性是仅体现在在少数几个基因座上(包括 FLC )。这种多样性与整合其他环境提示的途径中的变化相反,后者被认为是由多个位点的等位基因效应介导的。
对春化的需要定义了植物的不同生殖策略,同时,这也是 FLC 表达的产物。进一步说来,低温暴露前FLC表达的初始水平是建立开花能力所必需的寒冷时间的重要决定因素。这个表达代表了两个拮抗通路的整合输出,这两个通路决定了 FLC 的表达:
- FRIGIDA (FRI) 和激活FLC表达的相关调节因子
- 抑制FLC表达的自主途径
对这些途径的研究不仅阐明了FLC调控的细节,而且提供了对共转录过程的理解。
FRIGIDA 与 FLC 表达激活激活因子
FRI 最初是在开花时间变化的早期遗传分析期间确定的。尽管存在许多遗传修饰,但可以确定春化要求可以视为单基因性状。FRI 在1950年代首次通过遗传学被表征,于2000年被克隆,被证明编码一种有螺旋结构域的蛋白质。迄今为止,其功能模式尚不清楚,尽管它似乎通过与核帽结合复合物相互作用而直接激活FLC转录,从而增加了具有5'帽子的FLC mRNA的比例。此外,通过与FRL1、FES1、SUF4和FLX的相互作用,它们共同形成一个称为FRI-C的复合物,FRI促进了对FLC的染色质修饰因子的招募,例如染色质重塑SWR1复合物(传递H2A.Z)和组蛋白甲基转移酶EFS(SET2的同源物,催化H3K36me3)、ATX1(其催化H3K4me3)和SDG25。结果是增加了与高水平转录相关的染色质修饰水平,例如H3K36三甲基化,H3K4三甲基化以及H3和H4乙酰化。因此,FRI产生了一种染色质环境,可促进高水平的转录,并直接影响FLC的共转录过程。
此外,还需要其他更通用的转录激活因子来上调 FLC。其中包括RNA聚合酶相关因子1复合物(Paf1C),它调节向转录延伸阶段的转变;RAD6-BRE1,它对组蛋白H2B泛素化很重要;SKIP,它是与Paf1相互作用的剪接体的一个组成部分。这些激活子支持幼苗中高水平的转录,但对于重新激活春化植物胚胎中的 FLC 表达也很重要;这种再激活对于确保幼苗不“记住”其亲本的春化是必不可少的。
自主途径与反义转录
FRI在 FLC 表达上的活性被一组蛋白质所拮抗,这些蛋白质组成了我们所知的自主途径,因为它们的活性似乎在很大程度上独立于环境。总之,这个途径的组成部分FCA,FPA,FY,开花位点D(FLD),FLK,LUMINIDEPENDENS和FVE抑制 FLC 的表达,而与FRI活性无关。该途径的RNA处理和染色质活性形成RNA介导的染色质沉默机制,共同转录调控 FLC 的表达。这一机制在概念上与RNAi介导的裂殖酵母染色质沉默相似。其中三个成分FCA、FPA和FY起RNA处理因子的作用。这些成分是处理非编码FLC反义转录物所必需的,统称为 COOLAIR。COOLAIR是第一批被发现具有生物学功能的长非编码RNA(lncRNAs)之一。剪接或者聚腺苷酸化,其转录物分为两大类:
- 一组使用近端剪接位点和位于 FLC 内含子6内的多聚腺苷酸化位点
- 第二组使用位于FLC启动子中的远端剪接位点和远端剪接聚腺苷酸化位点
FCA和FPA部分冗余地控制拟南芥的3′加工和选择性剪接,并与FY、CstF64和CstF77(3′加工因子)一起促进近端 polyA 位点的利用。这种活性通过FLD依赖性降低H3K4me2水平导致 FLC 基因座染色质修饰的改变,从而抑制 FLC 的表达。诱导的染色质状态导致低效的转录起始和缓慢的转录延伸,后者是首先通过定量建模预测并随后通过RNA聚合酶延伸率的实验测量证实的特征。人们认为,染色质状态的反馈可以加强近端剪接和 polyA 位点的选择,这可能是通过一种动力学耦合机制,即聚合酶延伸和转录处理的协调允许延伸率的变化来影响加工。这种机制涉及到缓慢的RNA聚合酶II(PolII)延伸率,这一现象已经在现有文献中为其他系统所证实。除了这些自主途径的COOLAIR依赖性外,FVE被认为通过参与组蛋白脱乙酰化直接拮抗FRI-C的作用,特别是作为HDA6相关复合物的一个组分。
该途径的总体效果是协调和定量地影响 FLC 和 COOLAIR 的表达。荧光原位杂交(FISH)分析能够检测单个RNA分子,清楚地表明 FLC 表达和 COOLAIR 表达在每个基因座是相互排斥的。这种明显的矛盾很可能是由于正链和反义链相互排斥的转录,两者都受到反式因子和局部染色质环境的类似影响。反义转录是互斥的,这是 FLC 的另一个经验教训,可能是普遍相关的。
对 COOLAIR 的研究也揭示了反义转录调控的机制。COOLAIR 启动子形成一个R环,一种通过RNA侵入双链DNA形成的RNA-DNA杂交结构,减弱 COOLAIR 的转录。R环常与基因组损伤有关,但在 COOLAIR 中,是由新生的 COOLAIR 转录物局部侵入DNA形成的,阻止了进一步的反义转录。同源域蛋白NDX1稳定R环,赋予一种新的转录调控形式,可能在许多基因组中发挥重要作用。有趣的是, COOLAIR 启动子区域是小RNA介导的染色质沉默的目标,该区域同时产生30个nt和24个nt siRNA(后者与传统RNA沉默途径相关)。这是一个相对罕见的例子,非竞争性DNA成为RNAi机制的目标,提供功能上重要的染色质修饰。
这种复杂的相互作用网络在冷暴露之前就设定了 FLC 的表达水平,就像调光开关可以精确调节光照水平一样。因此,尽管 FLC 最初被认为是一个开关基因,其开关状态决定了开花能力,但 FLC 的表达受到了显著而细致的定量调控。由于这些初始水平决定了完全加速开花所需的冷时间,这种定量控制机制对于使开花符合环境最佳条件具有重要意义。
冬天来了:春化和表观遗传调控在冷寒冷注册和记忆中的应用
春化过程涉及 FLC 在响应冷暴露时的表观遗传沉默,其结果是建立开花能力。春化有不同的时间阶段(图2)。首先,在暴露于春化寒冷时,FLC转录的初始关闭,其在最初几周内发生并且与 COOLAIR 表达增加一致(图2b)。接下来,暴露于长时间的寒冷中后,表观遗传沉默是通过将抑制性染色质修饰局部沉积到 FLC 基因体内特定区域来介导的(图2c)。最后,通过这些抑制性标记在返回温暖时在整个基因座上的扩散来稳定沉默(图2d)。
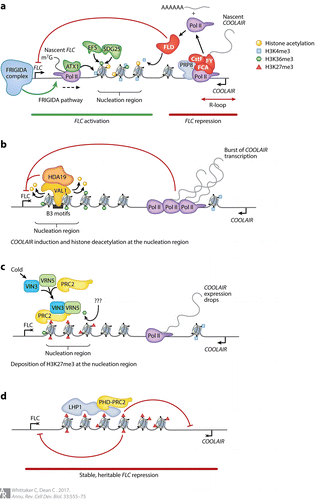
初始关闭和反义转录循环的复杂性
在春化的前2周内,FLC 表达的初始转录下调是由多种途径的联合作用介导的。冷暴露后,与 FLC 内含子1的特定区域(称为成核区域;见下文)中发现的两个B3顺式基序相关的蛋白VAL1招募组蛋白脱乙酰酶HDA19,导致转录减少。 COOLAIR 表达也显著上调,并导致FLC转录停止。COOLAIR 的表达在大约3周后达到最高水平,同时FLC的一个基因环被破坏。COOLAIR 转录本似乎并不是春化所必需的:T-DNA插入干扰 COOLAIR 表达的植物确实春化,但对 COOLAIR 生产中废除的转基因系的分析表明,在成核位点的染色质开关的协调性被破坏,此外,FLC 的转录下调较慢。
FLC组蛋白修饰的协同变化是基因座表观遗传沉默的基础
在最初的转录停止之后,FLC的长期表观遗传沉默,这一过程涉及基因座上一系列协调的染色质变化。在春化之前,FLC染色质富含大量与活跃转录基因相关的组蛋白修饰,包括H3K4me3、组蛋白2B泛素化、组蛋白乙酰化和(可能最显著的)H3K36me3。冷暴露后,这些标记从基因座上被动态移除,并被H3K27me3取代,H3K27me3是一种与多梳抑制基因(Polycomb-repressed genes)相关的修饰。尤其是H3K27me3和H3K36me3表现出相反的水平(profiles),这种拮抗作用被认为在建立相互排斥的染色质状态中具有重要的功能,这是通过 FLC 组蛋白动力学的数学模型产生的假说。该模型还预测了拮抗组蛋白修饰剂之间的物理联系,特别是H3K36me3甲基转移酶SDG8和H3K27me3脱甲基酶ELF6之间的物理联系;最近实验证实了这种预测。此外,这种模型强调了组蛋白修饰的功能拮抗和调节这些拮抗状态的活动的耦合的重要性,这可能是基于染色质的转录调控的共同特征。
最初,H3K27me3的沉积仅限于FLC基因的一个特定部分,称为成核区。这个区域跨越大约三个核小体,位于转录起始位点的下游,集中在外显子1和内含子1的起始处。H3K27me3的这种局部积累是由PRC2复合物介导的,PRC2复合物由多梳蛋白家族成员VRN2、SWINGER、FIE和MSI1以及一组PHD蛋白组成。一个PHD指蛋白VIN3,是冷诱导的;而VRN5,是组成性表达的。VIN3和VRN5被认为增加了PRC2组蛋白甲基转移酶的活性,导致H3K27me3的积累增加。
是什么将PRC2召集到特定的位点,这在文献中一直是一个争论的问题。FLC 的突变分析为这场争论提供了信息;非编码成核区内的单个突变阻断了VAL1的结合,VAL1是负责将PHD-PRC2召集到成核区域的序列特异因子。VAL1还与保守的凋亡和剪接相关蛋白复合物的成分相互作用,后者与PHD蛋白VIN3和VRN5相互作用,协助PRC2的召集。PHD-PRC2向成核区域的召集也被认为涉及另一个lncRNA即 COLDAIR,通过与PRC2的组蛋白甲基转移酶亚基的相互作用促进召集。然而,这种lncRNA的功能仍然是个谜,与 COOLAIR 不同,在十字花科的其他成员中尚未观察到这一现象。
关于寒冷的记忆与表观遗传沉默的稳定维持
感性诱导的Polycomb沉默核诱导转录抑制,然后在恢复温暖后建立稳定的,可遗传的沉默(通过Polycomb沉默和H3K27me3在整个基因座上的传播)。因此,FLC代表了一个罕见的系统,在这个系统中,建立和维护Polycomb沉默在空间和时间上都是分开的,这一特性允许人们很容易地剖析事件发生的顺序。事实上,通过这些不同的动力学机制得出的一个惊人的结论是,表观遗传沉默的数量变化是越来越多细胞中数字转换的结果,而不是单个基因座的数量变化。这一结论是通过定量模型预测的(随后通过实验工作得到证实),并且基于一个相对简单的概念:染色质状态是双稳态的,并且在状态之间存在动态切换。模型预测,H3K27me3在单个轨迹上的沉积以二进制开/关或数字方式发生;这种冷的数字注册有助于整合在现实生活中常见的嘈杂的,中断的温度信号。
然而,仍然存在的一个问题是,为什么H3K27me3的传播和表观遗传转换到稳定的沉默状态只发生在温度恢复之后。有可能是因为传播过程本身需要DNA复制:拟南芥DNA聚合酶α的催化亚单位是稳定维持 FLC 组蛋白修饰所必需的,突变体表现出H3K27me3不稳定的维持,在恢复温暖后导致重新激活。最近,DNA聚合酶ε(Polε)被证明可以招募PRC2的成分来介导基因的表观遗传沉默;Polε的催化亚单位ESD7与CLF、EMF2和MSI1相互作用,以促进PRC2招募到FT和SOC1的染色质中。因此,DNA复制可能在抑制性染色质标记从成核区域的初始位点传播到整个 FLC 位点中起到积极作用。不管怎样,在回归温暖时,多梳沉默的传播以及H3K27me3在基因体中的伴随建立了足够大的H3K27me3补丁来维持多梳沉默。对同一细胞中两个 FLC 荧光蛋白融合的分析表明,局部染色质环境足以指导沉默状态的表观遗传,强调并确认H3K27me3在基因体中的传播有助于维持Polycomb沉默,并基于先前提出的通过基于组蛋白的正反馈机制实现维持的工作。
这种染色质通过细胞分裂维持沉默反过来又依赖于许多蛋白质因子,包括 LHP1 基因座,它与 FLC 基因座有着物理联系。LHP1能够结合H3K27me3,与EMF1和组蛋白H3K4脱甲基酶形成复合物,在FLC和FT的表观遗传沉默状态维持中起作用。
然而,在植物中,生殖系起源于体细胞组织,这就需要(a)在植物的一生中,清除表观遗传修饰的机制的存在,以及(b)重新设定表达以防止春化状态的遗传。含有jumonji结构域的ELF6蛋白具有H3K27me3脱甲基酶活性,有助于植物胚胎春化状态的重置。
FLC表观遗传沉默伴随着显著的结构变化
基因调控的一个新主题是细胞核内物理位置和空间位置的重要性。在FLC也发现了类似的情况,除了动态转录和表观遗传重编程外,春化过程中核组织和物理结构也发生了显著变化。染色体构象捕获分析显示FLC存在一个基因环,涉及到5′和3′区域之间的物理相互作用。有趣的是,尽管该环不受与建立基因座表达水平有关的各种成分突变的影响,但在春化过程中冷暴露时它会被显著破坏。因此,在转为沉默染色质状态之前,该环可能在转录关闭的早期阶段发挥作用。
此外,FLC-lacO的活细胞成像显示,有丝分裂细胞中的FLC等位基因在寒冷时聚集在一起,并在温度恢复时保持这种聚集状态。这种聚集依赖于上述参与FLC沉默状态建立的PRC2成分,但不依赖于有助于维持沉默的LHP1。这一发现支持了这样一种观点,即细胞核内的物理聚集既代表了多囊成核的物理表现,也可能是基因调控的一个保守而重要的方面。春化途径揭示了染色质沉默机制的许多方面的重要见解。
从差异、守恒原理看FLC与适应的分子机制
尽管FLC存在于许多双子叶植物中,在春化过程中起着重要作用,但在整个植物界,春化反应存在着显著的差异。首先,在是否具有春化需求方面,物种之间(以及单个物种的材料之间)存在差异。第二,对于那些需要春化的植物,所需的低温时间也有很大的差异。最后,在生活史结构和如何适应春化需求方面存在显著差异:尽管许多物种采用每年开花的习性,但其他物种是多年生的,并且在这一时期多次开花。
同一物种,不同的故事:关键春化成分的编码变异支持不同的生命史策略
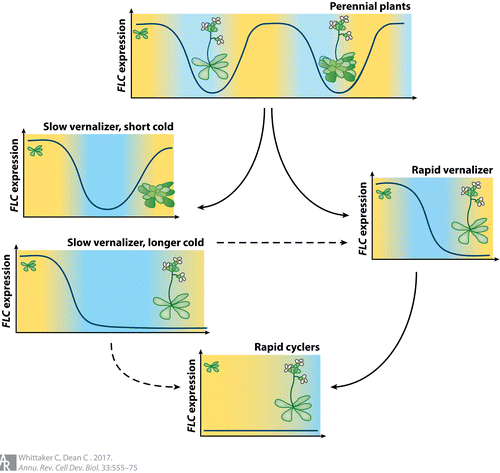
在A.thaliana中,所使用的繁殖策略有显著的差异(图3)。这些差异的遗传基础发生在一系列基因座上,但主要是通过FRI和FLC的等位基因变异。许多快速循环(缺乏春化要求的材料)含有导致功能丧失的FRI突变等位基因,包括无义突变以及导致提前终止的改变。这种现象似乎已经在拟南芥种群中独立进化了至少20次,突出了趋同表型的不同进化路径。弱的FLC等位基因也会导致快速的循环习惯,特别是Van-0被鉴定为具有FLC无义突变,从而导致早期开花。相反,春化要求强的材料一般都具有FRI和FLC的活性拷贝,FRI的激活作用增加了FLC的表达,从而导致对春化的需求。
更温和的接触:对春化反应的更精细的调控
尽管对FRI或FLC的显著破坏足以促使它们从一个以年为基础的生命史转变为一个快速循环的生命史,但这些位点(特别是FLC)的变异也有能力对春化进行更精细的调节,从而适应当地的气候。对1307份A.thaliana材料的FLC功能多样性分析表明,存在多个功能上不同的FLC单倍型,每个单倍型由特定的非编码变异(几乎完全编码序列守恒)定义。共鉴定出20种单倍型,其中5种在世界范围内占优势。对这5份材料的分析表明,特异的春化表型是FLC沉默动力学改变的结果。
Lövvik-1和Var2–6 FLCs:趋同表型的发散途径
对单个等位基因的机制研究极大地丰富了我们对FLC核苷酸序列多样性在产生不同春化反应中的作用的认识。一个值得注意的例子是Lövvik-1(Lov-1)的FLC等位基因,它来自瑞典北部高海岸地区,靠近拟南芥的北部界限。它是迄今为止研究的春化速度最慢的材料之一,需要在5°C的低温下进行3个月的春化,才能完全加速开花。与Edi-0这样的材料相比,春化速度较慢,在这种材料中,仅经过4周的低温,春化反应就完全饱和。
对Lov-1慢春化表型的遗传基础进行分析,发现FLC 5′端附近有4个非编码单核苷酸多态性(snp)的区域,该区域负责不同春化反应。这种遗传变异定量调节PRC2介导的表观遗传沉默,并增加达到必要的H3K27me3水平所需的时间。这些单核苷酸多态性究竟是如何影响这一机制仍有待确定。Lov-1还具有一个改变的最佳春化温度:尽管大多数材料在2℃、5℃和8℃下春化效率相同,但Lov-1优先在8℃春化,这一现象导致春化发生在秋季。春化时间的季节性变化可能代表了对瑞典北部极端冬季的适应,有助于融雪后迅速开花。
与此相反,作者观察到另一个亚低温组的剪接反应发生了变化,与之相反的是,在另一个冷态组中观察到了另一个冷态的剪接反应。进一步的分子鉴定表明,FLC内含子1中的单个非编码核苷酸变化,特别是从a T到a G的变化,足以改变剪接位点的利用率,使得最后一个远端外显子被截断了54 bp,并加入了额外的64 bp外显子。COOLAIR反义转录物的剪接改变显著增加了FLC转录,使Var2–6需要更长时间的低温才能完全春化。在COOLAIR生产中被废除的转基因株系的分子特征表明,这种效应依赖于COOLAIR,COOLAIR功能的改变通过一种共转录机制增加FLC的表达,包括新生FLC转录物的封顶。因此,在进化上不同的材料上,春化机制的不同方面似乎已经被调节,以实现春化反应功能上的相似变化。春化的过程显然可以如此迅速地进化,这可能解释了地中海盲蝽的地理分布范围之广。
春化要求与生活史策略
除了这些种内比较之外,对密切相关的多年生物种(如阿拉伯高山)中FLC的作用模式的研究也大大有助于我们理解支持这些不同生活史策略产生的进化事件(图3)。一年生植物在一年内完成其整个生命周期,而多年生植物则能存活多年并反复开花。对拟南芥和高山拟南芥春化作用的研究表明,FLC同系物对冷暴露的反应表现出季节性的抑制循环,并且与A.thaliana一样,FLC抑制是导致开花开始的原因。然而,与拟南芥不同的是,高山葡萄球菌的抑制并不稳定,只是短暂的。抑制和活跃的FLC状态之间的这种变化允许一部分分生组织保持营养状态,同时允许其他分生组织在寒冷环境下开花。进一步分析了A.thaliana和A.alpina之间的差异,强调了H3K27me3在产生沉默FLC状态时的守恒性,并且由于该组蛋白标记的丢失而重新激活。因此,这种染色质修饰的调控和维持的差异导致了两个物种之间的生活史差异,进而提出了冬季一年生拟南芥种质春化要求的多样性是否可能代表祖先多年生条件的衍生的问题。FLC-cis调控序列的微小变化可能会影响表观遗传沉默的程度,将多年生植物转化为冬季一年生植物,从而允许在不同的地理范围内进行定殖。
老问题,新玩家:FLC,进化适应,长非编码RNA
小变化,大后果:非编码单核苷酸多态性作为主要进化变化的驱动因素
FLC基因座非编码区的这种微小变化影响了拟南芥表型的这种大的变化,这为关于支持宏观适应性进化的不同类型的分子变异的争论提供了信息。调控和基于蛋白质的变化的相对贡献长期以来一直存在争议,尽管有证据表明它们在适应性进化中的作用,但蛋白质编码、非编码和顺式调控突变的相对优势一直备受争议。
春化作用的研究已经确定了顺式非编码变异和基于蛋白质的变化的作用,但表型结果有些不同。FRI和FLC的功能缺失突变使植物能够在不需要春化的情况下开花,并采取快速循环的习惯,而顺式非编码变异具有更微妙的影响,允许对特定纬度和不同环境的特定气候条件的春化反应进行微调。在这两种情况下,这种变异仅仅是少量改变的产物:要么是单个无义突变,要么是FLC非编码区的一些snp。
以前被忽视的新视角:非编码变异和长非编码rna
特别令人感兴趣的是,FLC基因座的变异可能提供了对长非编码转录功能(lncRNAs)的洞察。lncRNA在序列上的保守性通常很差,一些研究者认为大多数lncRNA仅仅代表转录噪声。然而,越来越多的证据表明,许多lncRNA在不同的过程中扮演着不同的角色。这种功能性似乎主要是由于二级(和更高阶)RNA结构的结果,而不是确切的序列。
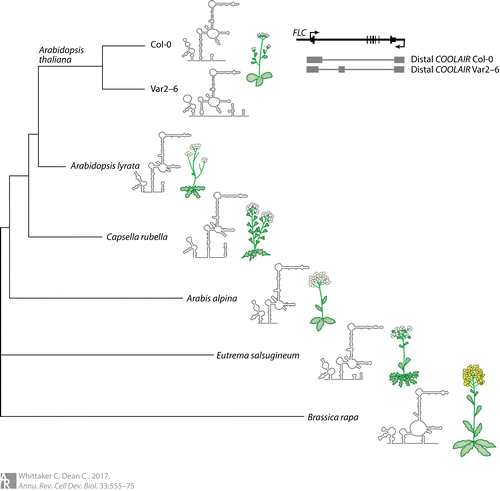
尽管COOLAIR一级序列缺乏保守性,但最近对广泛芸薹科植物剪接COOLAIR变异体的体外二级结构的测定揭示了重要而精细的二级结构(图4)。来自拟南芥、风疹卷心菜和盐芥的远端多聚腺苷酸化COOLAIR变体与拟南芥具有显著的二级结构保守性。然而,在快速春化Col-0-FRI-Sf2和缓慢春化的Var2-6材料之间的比较中可以明显地看到这些差异。这些差异是由于Var2–6中COOLAIR剪接改变的结果,Var2–6是邻近远端剪接位点的单个SNP的产物。这种改变的结构因此调节了COOLAIR的功能,引起了观察到的表型变异。因此,lncRNA二级结构和功能的调节可能在适应性进化中发挥重要作用。事实上,我们可以推测,不同细胞类型的lncRNA不受蛋白质编码能力和更高的自然表达变化的影响,这可能使lncRNA特别适合于通过变异和进化力进行快速和动态的重塑。支持这种可能性的是最近的证据表明,roX1和roX2 lncRNA在果蝇物种中的快速进化更替,尽管这些lncRNA与功能所需的基因组DNA的相互作用模式有着广泛的保守性。



 浙公网安备 33010602011771号
浙公网安备 33010602011771号