生物化学课程笔记
绪论
历史
| 时间 | 节点 |
|---|---|
| \(6\) 世纪 | 我国已会酿酒 |
| \(1789\) | 拉瓦锡发现呼吸是燃烧 |
| \(1828\) | 无机合成有机 |
| \(1894\) | 就懂了蛋白质肽键,生化建立 |
| \(1950\) | 生化已独立 |
| \(1953\) | 测定dna双螺旋 |
生命特点
- 新陈代谢
- 自我繁殖
- 高度组织化,有序
- 生物分子
- 由30种轻元素构成
- 是碳化合物
- 生物大分子为多聚体
- 具有3d结构特征
- 之间的互作具有立体特异性
水
- 作用
- 良好溶剂
- 全部反应在水中进行
- 底物或产物
- 蛋白质内疏水外亲水,所以水方便形成大分子
- 稳定:温度、密度等
- 良好溶剂
- 介电常数大,更能拆散离子,溶解度大
- 即使不带电荷,极性分子的话也能形成氢键
- 双亲分子能在水中形成膜或团
- 水的解离有助于缓冲
氨基酸
简介
| 名称 | 符号 | 字母 |
|---|---|---|
| 甘氨酸 | Gly |
G |
| 丙氨酸 | Ala |
A |
| 脯氨酸 | Pro |
P |
| 缬氨酸 | Val |
V |
| 亮氨酸 | Leu |
L |
| 异亮氨酸 | Ile |
I |
| 甲硫氨酸 | Met |
M |
| 苯丙氨酸 | Phe |
F |
| 酪氨酸 | Tyr |
Y |
| 色氨酸 | Trp |
W |
| 丝氨酸 | Ser |
S |
| 苏氨酸 | Thr |
T |
| 半胱氨酸 | Cys |
C |
| 天冬酰胺 | Asn |
N |
| 谷氨酰胺 | Gln |
Q |
| 天冬氨酸 | Asp |
D |
| 谷氨酸 | Glu |
E |
| 赖氨酸 | Lys |
K |
| 精氨酸 | Arg |
R |
| 组氨酸 | His |
H |
| 硒代半胱氨酸 | Sec |
U |
| 吡咯赖氨酸 | Pyl |
O |
- 蛋白质的氨基酸在 \(\mathrm{pH}=7.0\) 时是
C(*)([Ac-])[NH3+] - \(20\) 种常见蛋白质氨基酸
- \(22\) 种有密码子的标准氨基酸
- \(20+n\) 种蛋白质氨基酸
- \(>300\) 种非标准氨基酸,在标准氨基酸上修饰而得
- 常见氨基酸:
-
非极性,疏水:
- 蛋白质折叠、稳定
- 三维结构
- 非极性或脂肪族
- 芳香族(
Tyr带极性)
-
极性、亲水:
- 酶的活性中心,参与催化反应
- 共价修饰:磷酸化、甲基化等
- 极性不带电荷
- 正电荷 / 酸性
- 负电荷 / 碱性
-
- 成人必需氨基酸:笨
Phe(蛋)来Lys宿Thr舍Trp,晾Leu一晾Ile假Met鞋Val - 半必需氨基酸:
ArgHis
非极性或脂肪族
疏水
-
甘氨酸 /
Gly/G最简单,唯一无旋光性的
[*H] -
丙氨酸 /
Ala/A[*]C -
脯氨酸 /
Pro/P刚性构象
C([NH2+]1)(CCC1)([Ac-]) -
缬氨酸 /
Val/V*C(C)C -
亮氨酸 /
Leu/L*CC(C)C -
异亮氨酸 /
Ile/I*C(CC)C -
甲硫氨酸 /
Met/M*CC[S]C
芳香族
有紫外吸光能力,在 \(280\ \mathrm{nm}\) 有特征光吸收,可用于测定蛋白质含量
-
苯丙氨酸 /
Phe/F诊断苯丙酮尿症
*CC1=CC=CC=C1 -
酪氨酸 /
Tyr/Y\(\mathrm{-OH}\) 形成氢键,有极性
*CC1=CC=C(O)C=C1 -
色氨酸 /
Trp/W维生素的一种
*CC(=CN2)C1=CC=CC=C21
极性不带电荷
亲水性大,能与水形成氢键
-
丝氨酸 /
Ser/S*CO -
苏氨酸 /
Thr/T*C(O)C -
半胱氨酸 /
Cys/C- 硫基形成氢键
- 易形成二硫键
- 易氧化成二聚胱氨酸
*(CS) -
天冬酰胺 /
Asn/A易被水解为游离氨基酸
*CC(=O)([NH2]) -
谷氨酰胺 /
Gln/Q易被水解为游离氨基酸
*CCC(=O)[NH2]
负电荷
\(\mathrm{pH}=7.0\) 时, \(\mathrm{-COOH}\) 完全解离,带负电
-
天冬氨酸 /
Asp/D*CC(=O)O -
谷氨酸 /
Glu/E*CCC(=O)O
正电荷
-
赖氨酸 /
Lys/K*CCCC[NH3+] -
精氨酸 /
Arg/R*CCCCC(=[NH2+])[NH2] -
组氨酸 /
His/H- \(\mathrm{pH}=6.0\) 时, \(50%\) 质子化
- \(\mathrm{pH}=7.0\) 时,质子化 \(<10%\)
- 质子供体和接纳体,酶促反应中发挥重要功能
*CC1[NH]C=[NH+]C=1
其他
-
硒代半胱氨酸 /
Sec/U含硒蛋白质中有
*C[SeH] -
吡咯赖氨酸 /
Pvl/O*CCCC[NH]C(=O)C1N=CCC1C
性质
酸碱性质
- \(\mathrm{pH}>3.5=\mathrm{p}K_1\) ,氨基酸是 \(\mathrm{-COO^-}\)
- \(\mathrm{pH}<8=\mathrm{p}K_2\) ,氨基酸是 \(\mathrm{-NH_3^+}\)
- 所以是两性电解质,既是质子供体,又是接纳体
- 如果 \(\mathrm{-R}\) 也能解离,那氨基酸会有三种单体, \(\mathrm{p}K_R\)
- 组氨酸
His的 \(\mathrm{p}K_R\approx 6.00\) 附近,所以具有很好的缓冲能力 - 等电点:物质主要以净电荷为 \(0\) 的形态存在时两侧 \(\mathrm{p}K\) 的平均值
- 酸性氨基酸的等电点 \(<\mathrm{p}K_R\) ,碱性氨基酸 \(>\mathrm{p}K_R\)
- 不同 \(\mathrm{pH}\) 下不同氨基酸带不同电荷,是电泳法分离氨基酸
化学性质
\(\alpha\) 羧基
-
酯化:保护羧基,氨基活性增加,蛋白质合成用
图例
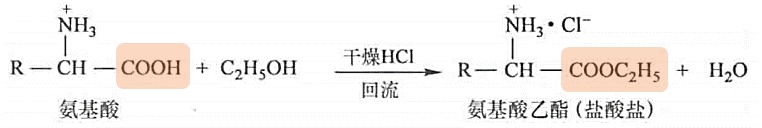
-
酰氯化,叠氮反应:羧基被活化,易与另一个氨基酸形成肽键,人工合成蛋白质
图例
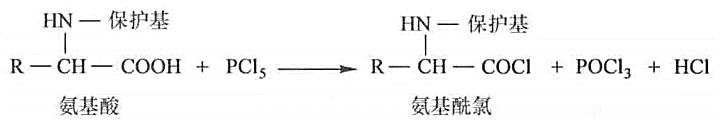
-
酰胺化:天冬,谷氨
图例
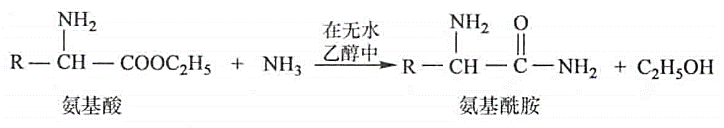
-
脱羧基反应:酶分解,用瓦勃呼吸计测co2可测定氨基酸含量
\(\alpha\) 氨基
-
羟基化
- Sanger / DNFB 反应:产生黄色的 DNP 氨基酸,用于鉴定蛋白质和多肽的 N-末端氨基酸的残基
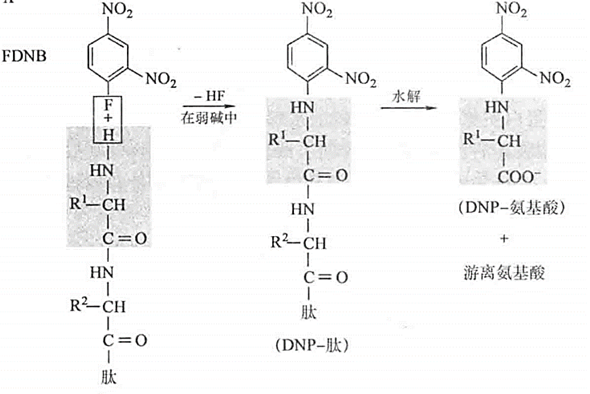
- Edman / PITC 反应:从肽链上一次抠下来一个氨基酸,进行 \(n\) 轮反应来测定 \(n\) 个序列,一般一次性测 \(50\sim60\) 个
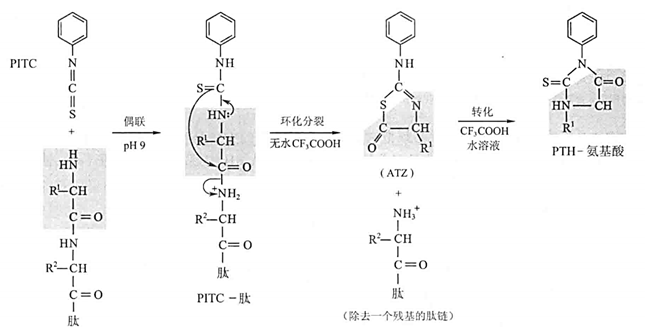
- Sanger / DNFB 反应:产生黄色的 DNP 氨基酸,用于鉴定蛋白质和多肽的 N-末端氨基酸的残基
-
酰化:保护氨基,蛋白质合成用
图例

-
生成弱碱西弗碱:酶促反应的中间产物,赖氨酸侧链也可以发生
图例
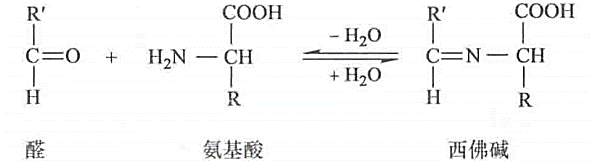
-
脱氨基反应:氨基酸代谢的第一步
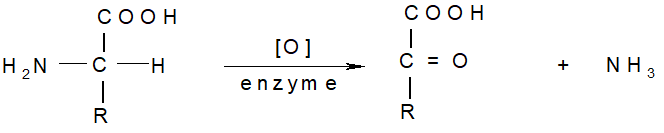
-
DNS-Cl 试剂:标记肽链氨基那头的氨基酸,带有强烈荧光
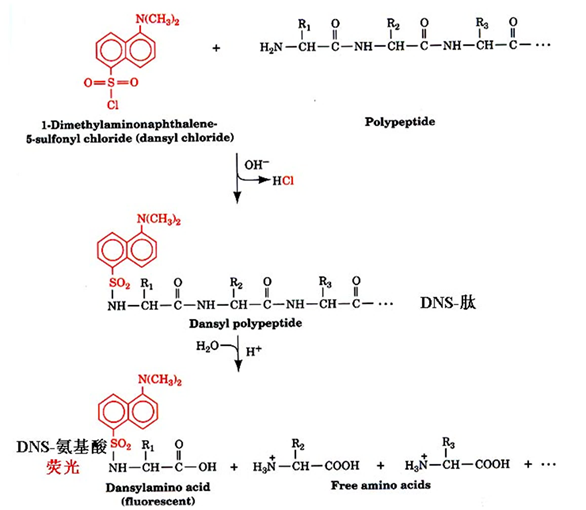
两者共同
-
成肽反应:肽链有顺序
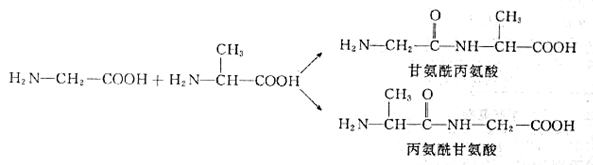
-
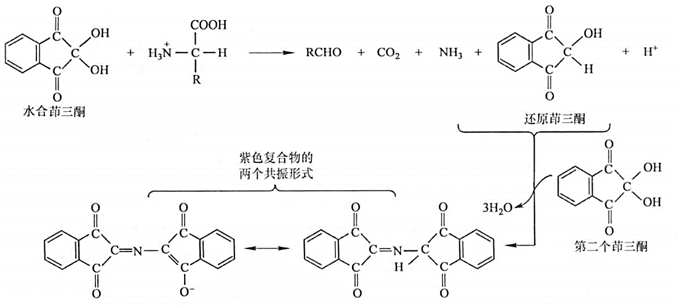
茚三酮反应:非常灵敏测定蛋白质
脯氨酸是亚氨基酸,此反应不黄不放氨气,而是直接形成黄色物质图例
侧链反应
- 酪氨酸:碱性下使 Folin-酚生成蓝色,可定量测定
- 半胱氨酸
- 空气弱氧化,稳定蛋白质
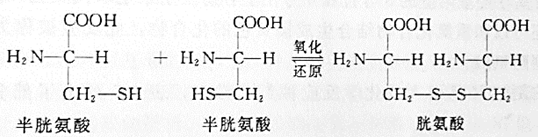
- 强氧化剂强氧化,测定结构时打开二硫键用
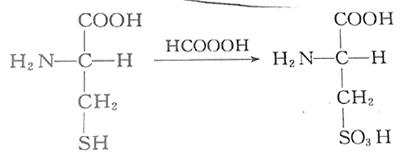
- 烷基化:烷化剂糊住硫基,保护或使蛋白质失去作用
- 空气弱氧化,稳定蛋白质
物理性质
- 白色晶体,熔点 \(>200\ \degree \mathrm{C}\)
- 每种的结晶形状都不一样
- 大部分溶于水
- 除胱氨酸和酪氨酸,溶于烯酸碱
- 脯氨酸溶于乙醇和乙醚,其他不溶有机溶剂
- 几乎所有蛋白质的氨基酸都是 L 左旋构型,不过细菌也能利用 D 右旋构型
蛋白质
分类
- 简单 / 缀合:是否完全由氨基酸构成
- 球状:溶水,功能蛋白 / 膜蛋白:不溶水,和膜系统结合 / 纤维状:难容水,结构蛋白
- 酶:催化
- 转运蛋白:大门
- 收缩和运动蛋白:运动
- 结构蛋白:支撑
- 防卫和保护蛋白:免疫
- 贮存蛋白:酪蛋白、铁蛋白之类
- 调节蛋白:信号
- 支架蛋白:用于捆起多个蛋白
形状决定因素
- 肽键
- 疏水作用:疏水蛋白质聚在一起,外面水包住,形成疏水核
- 氢键:疏水核内部氢键配对引起折叠,常为重复的二级结构抱在一起
- 离子键:稳定极性水到非极性疏水核,也限制蛋白质柔性
- 范德华力:非极性分子相互吸引,是群体而非单个发挥效用
一级结构
- 肽键
*C(=O)[NH]* - 变形不破坏一级结构
- 多肽链氨基酸的顺序和连接方式,还有共价连接的辅基的连接方式
- 读法:从左氨基到右羧基,某氨酰某氨酰……某氨酸
- 蛋白质中肽键 \(反式:顺式\approx 1000:1\) ,但脯氨酸的 \(反式:顺式\approx10:1\)
- 可变氨基酸:可以被取代甚至消失
- 保守氨基酸:取代或缺失会导致功能降低甚至丧失
- 同源蛋白质:不同生物实现同一功能的蛋白质
测定序列
- FDNB
- PITC
- DNS-Cl
- 氨肽酶会从 \(\mathrm{N}\) 末端一个一个向里切,关注切下的氨基酸和时间的关系
- 肼解法:单独扣下来 \(\mathrm{C}\) 末端氨基酸溶于水,剩下的肽链不溶于水,和 DNS-Cl 有点像
- 羧肽酶会从 \(\mathrm{C}\) 末端向里切,但是脯氨酸不能用
- 专一裂解
- 溴化氢能裂解甲硫氨酸的羧基肽键
- 羟胺能裂解天冬酰胺-甘氨酸之间肽键
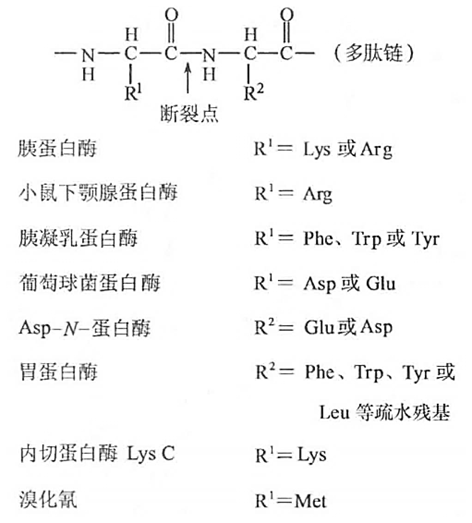
- 肽段重叠法拼接
- 对角线电泳来找二硫键
- 串联质谱法:喷射、分离肽段、惰性气体碰撞为碎片、质荷比分离、检测
- 搜索数据库
二级结构
-
氢键
-
肽链上 \(\mathrm{C_\alpha-N}\) 键角度叫 \(\phi\) 角
-
\(\mathrm{C_\alpha-C}\) 键角度叫 \(\psi\) 角
-
两个角度互相牵制,形成拉氏构象图
图例
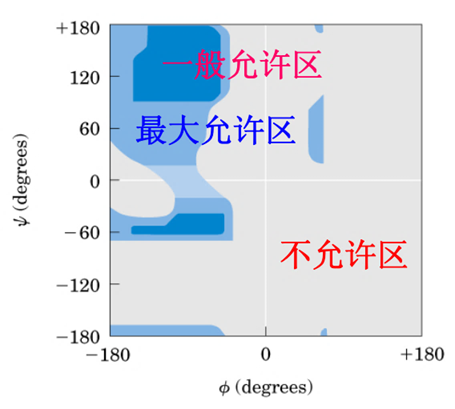
-
\(\alpha\) 螺旋
- 每个氨基酸旋转 \(100\ \degree \mathrm{C}\) , \(3.6\) 个氨基酸上升一圈
- 圆筒状
- 第一个氨基酸的羰基和第五个氨基酸的氨基的氢键
- \(-\mathrm{R}\) 在筒子外侧,通常小且不带电荷——至少不连续出现同种电荷
- 天然蛋白质多为右手螺旋
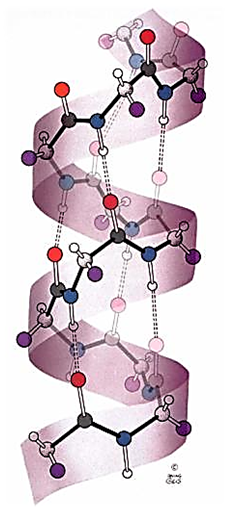
-
\(\beta\) 折叠 / 片层
- 并列同向或反向(更稳定)排列的多肽链,侧向相邻的羰基和氨基氢键相连
- \(\mathrm{-R}\) 沿着肽链一上一下,锯齿一样
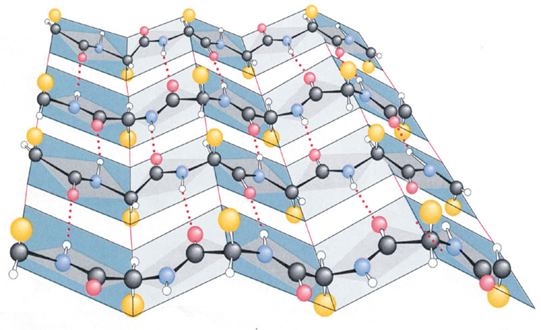
-
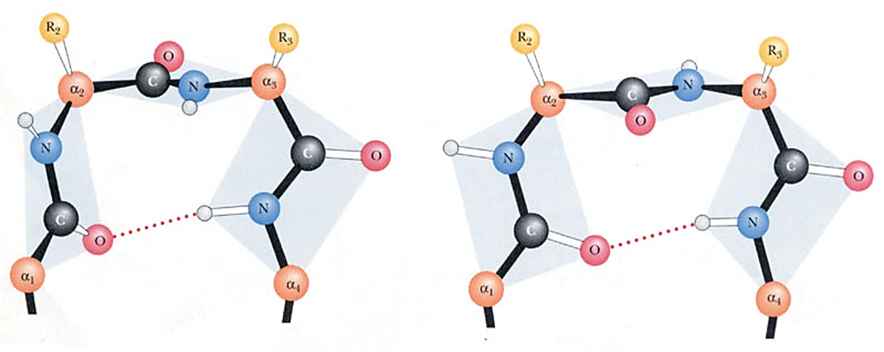
\(\beta\) 转角
- 折叠到头,转过来, \(4\) 个氨基酸残基组成
- 第一个羧基和第四个氨基氢键
- 甘氨酸柔性大,脯氨酸易顺式,常出现
-
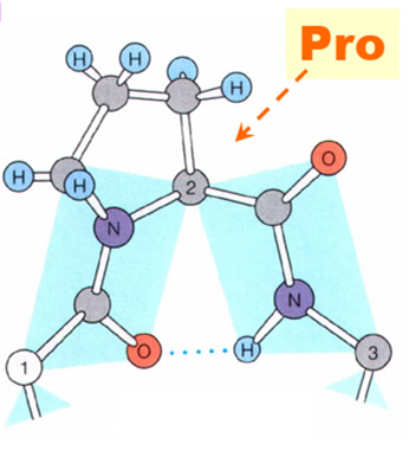
\(\gamma\) 转角
- 剧烈转角, \(3\) 个残基组成
-
\(\Omega\) 环
- \(\beta\) 转角的延伸
- \(6\sim 8\) 个氨基酸,绕成环
-
超二级结构:多个二级结构拼在一起
-
\(\alpha\) 角蛋白 \(\beta\) 角蛋白 头发 鳞片 链间二硫键 链间氢键;层间范德华力 所以刚性 柔软 弹簧一样可伸缩 不可伸缩 -
胶原蛋白是三股螺旋,甘氨酸和脯氨酸多
-
二硫键细胞内少,细胞外氧化性强,易形成
三级结构
- 多为球状
- 类似一级结构,三级结构和功能也类似,类似三级结构或功能,不一定一级结构类似
- 结构域:相对独立的紧密球状结构区域,在二级或超二级上形成局部折叠区,是球状蛋白质的折叠单位
- 功能域:能够独立存在的功能单位,一个、两个或以上结构域
- 分子伴侣: 协助折叠,但不是成熟蛋白的组成成分,如陪伴蛋白、各种热休克蛋白
四级结构
- 每个具有三级结构的链叫做亚基
- 单体、寡聚和同多聚 / 杂多聚蛋白
血红蛋白
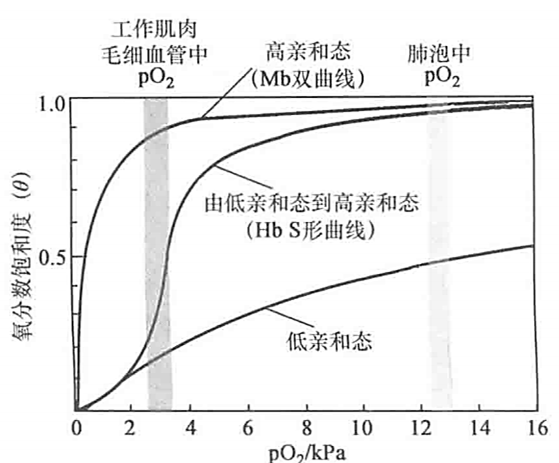
- 别构效应:配体与一个部位结合影响其他部位的亲和力,正 / 负协同效应
- 四聚体,两条 \(\alpha\) 两条 \(\beta\)
- T态 tense 紧张态,氧亲和力低
- R态 relaxed 松驰态,氧亲和力高
- 跟 H+和CO2 的结合与跟O2的结合是拮抗的关系
- 在外周组织中,pH相对较低,CO2 浓度相对较高,血红蛋白对O2的亲和力降低,促进O2的释放
博客园原文链接:https://www.cnblogs.com/QiFande/p/19226362,转载请注明。
如果你对本篇文章感兴趣,不如来看看肉丁土豆表的其他文章,说不定也有你喜欢的。


 浙公网安备 33010602011771号
浙公网安备 33010602011771号