选择性必修1 化学反应原理 小记
可能是易错
电导率不止要看离子数量,还要看加入水引起的浓度变化。
每个基元反应对应一个活化能,因此历程中的最大活化能并不是减初始能量。
碱性溶液电解时 \(\mathrm{CO_2 + 2OH^- \xlongequal{\;\;} CO_3^{2-} + H_2O}\)
推拉活塞会直接影响浓度而改变颜色,然后才是平衡移动。
\(\mathrm{NO_2}\) 有颜色,而不是 \(\mathrm{N_2O_4}\)。
判断正负极时:正极电势高,得到电子,负极电势低,失去电子。
\(\Delta H\) 是反应物键能减生成物键能,别减反了,可以用极端情况验证:\(\mathrm{H_2 \xlongequal{\;\;} 2H} \;\; \Delta H > 0\)。
固体的反应速率不能用浓度表示,因此单位有 \(L^{-1}\) 直接错。
交换膜上穿过的离子数量是按照电子数量而不是化学方程式需要的离子数量来算的。
升高温度时 \(v_{\text{正}}\) 和 \(v_{\text{逆}}\) 均增大。
稀释酸时,并不是所有的离子浓度均减小:\(\mathrm{OH^-}\)。
图表的浓度/其他数据可能不止指一个量。
多检查一下 pH 比大小的方向。
连上双键的能量不要用成连上单键的能量。
绝热过程指的是不与外界进行热量交换,等温才指控制温度不变。
题干里可能给定了反应物的量之比,从而使得一些判断平衡的条件正确。
注意问的是 \(\mathrm{H^+}\) 浓度还是由水电离出的 \(\mathrm{H^+}\) 浓度。
由水电离出的 \(\mathrm{H^+}\) 浓度无法区分溶液的酸碱性。
与 \(\mathrm{CO_2}\) 反应写 \(\mathrm{CO_2 + H_2O}\) 而不是 \(\mathrm{H_2CO_3}\)。
注意给出标准摩尔生成焓时物质的状态。
一些知识点
铅蓄电池:\(\mathrm{2PbSO_4 + 2H_2O \xrightleftharpoons[\text{放电}]{\;\text{充电}\;} PbO_2 + Pb + 2H_2SO_4}\)。
弱酸与弱碱的中和,但看着比较怪的一个反应:\(\mathrm{CH_3COOH + NH_3\cdot H_2O \xrightleftharpoons{\quad} CH_3COONH_4 + H_2O}\)。
高锰酸钾滴定草酸:\(\mathrm{2MnO_4^- + 5C_2O_4^{2-} + 16H^+ \xlongequal{\quad} 2Mn^{2+} + 10CO_2 \negthinspace \uparrow + 8H2O}\)
\(\mathrm{KMnO_4}\) 酸性溶液中氧化性强;滴定时颜色完全褪去后再滴下一滴;\(\mathrm{Mn^{2+}}\) 的催化使得后期可以加速滴定。
一些平衡的移动
计算中 \(\mu, \nu\) 表示对指标求和,\(c_i\) 表示常数,\(\xi\) 为反应进度,默认恒温/初末温度相同,且反应为气态。
设方程式为 \(p_\mu\mathrm{P}_\mu \xrightleftharpoons{\quad} q_\nu\mathrm{Q}_\nu\),平衡常数为 \(K_c\),有:
由 \(p = cRT\),液态相当于恒容时的气态,稀释时相当于降低压强。但注意并没有给液态体系改变压强的说法,也注意水的浓度不变。
1. 恒压时,反应物成比例增加或减少形成等效平衡,不影响平衡转化率。
这一点很好直观的理解,从计算上验证也只需要注意到平衡满足的方程式是齐次的即可。
2. 恒压时,投料比恰为系数之比时生成物所占体积分数最大。
记 \(w_p = p_\mu, w_q = q_\nu, w = w_p - w_q, t = n_\mu - \xi\),则有:
这一点有两个显然的推论:
- 恒压时,若原料摩尔数之和一定,投料比恰为系数之比时生成物体积分数(反应进度)最大;
- 恒压时,若固定一种原料摩尔数,投料比恰为系数之比时生成物体积分数最大。
3. 恒容时,若原料摩尔数之和一定,投料比恰为系数之比时生成物体积分数(反应进度)最大。
可以从基本的式子验证,但是我们可以引用之前的结论,设 \(\max \xi = \xi^*\)。
容易发现,由于初始摩尔数一定,\(\xi^*\) 对应了一个定值压强 \(p^*\),在这个压强下有 \(\xi^* = \max \xi\)。
但是恒压时,在投料比恰为系数之比时取到最值,因此恒容时的最值也在投料比恰为系数之比时取到。明所欲证。
4. 恒容时,若固定一种原料摩尔数,其余投料比恰为系数之比且依计量数比固定的原料与系数之比略高/低时生成物体积分数最大。
对于恒容而言,其相当于在恒压的基础上还依照 \(w = w_p - w_q\) 增减了压强。故若 \(w > 0\) 则其余投料略高时取到极值,\(w < 0\) 则其余投料略低时取到极值。
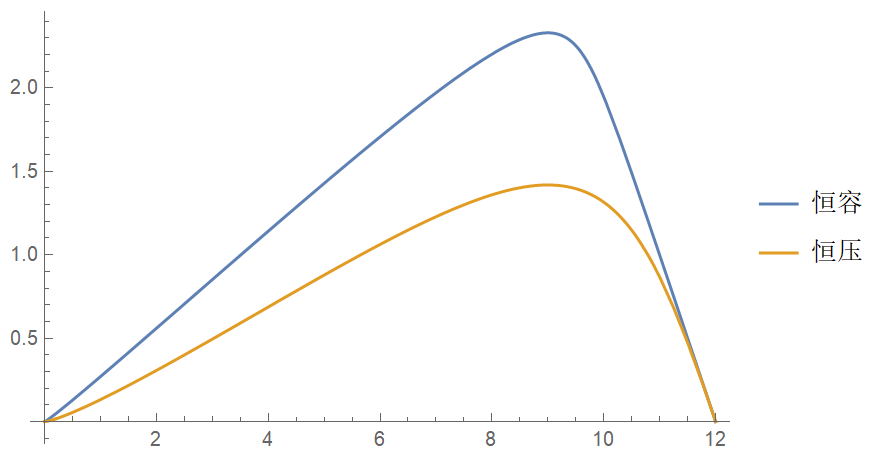
例子:\(\mathrm{N_2 + 3H_2 \xrightleftharpoons{\quad} 2NH_3}\)。
固定 \(n(\mathrm{N_2}) + n(\mathrm{H_2}) = 12\),\(K_c = 0.25\),恒容 \(V = 1\),恒压 \(p = 1\),横轴为 \(n(\mathrm{H_2})\),纵轴为 \(\xi\)。
固定 \(n(\mathrm{H_2}) = 6\),\(K_c = 0.25\),恒容 \(V = 1\),恒压 \(p = 1\),横轴为 \(n(\mathrm{N_2})\),纵轴为平衡时 \(\displaystyle \frac{n(\mathrm{NH_3})}{n(\mathrm{H_2})+n(\mathrm{N_2})+n(\mathrm{NH_3})}\),此处 \(n(\mathrm{N_2}) = 2.10487\) 时取最值。
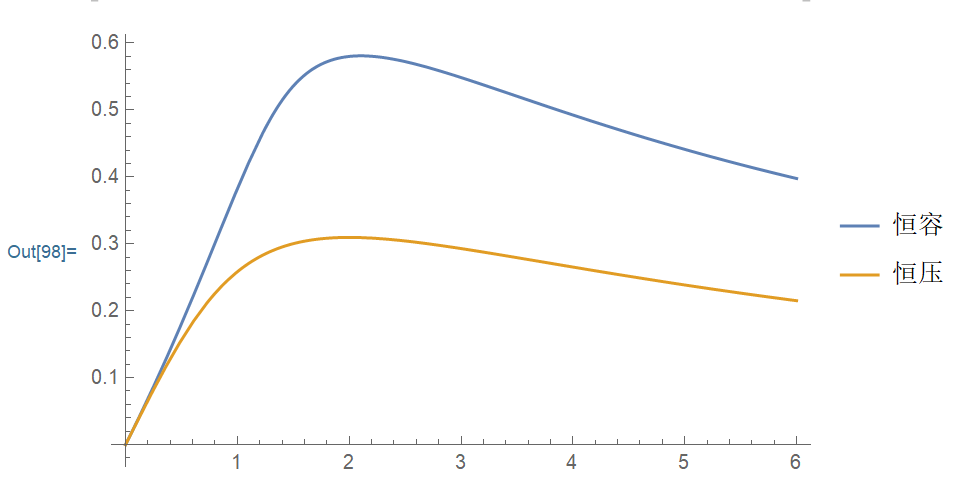
一个小总结:生成物体积分数主要受 \(p\) 与投料比两个因素控制,前者依计量数而影响生成物的体积分数,后者依与系数之比的相近程度影响生成物的体积分数。
5. 同体积,同 pH 的酸稀释相同倍数,\(K\) 越小的酸 \(c(\mathrm{H^+})\) 越大。
考察 \(\displaystyle \frac{\xi^2}{n-\xi} = KV\),有 \(\displaystyle \frac{\mathrm dV}{\mathrm d\xi} = V\left(\frac{2}{\xi}+\frac{1}{n-\xi}\right)\)。
存在常量 \(\xi_0, V_0\) 使得 \(\displaystyle \frac{\xi_0^2}{n-\xi_0}=KV_0\),则 \(\displaystyle\frac{\mathrm dV}{\mathrm d\xi} = V_0\frac{n-\xi_0}{\xi_0^2}\frac{\xi^2}{n-\xi}\left(\frac{2}{\xi}+\frac{1}{n-\xi}\right)\)。
由 \(\xi_0 < \xi\),\(\displaystyle \frac{\mathrm dV}{\mathrm d\xi}\) 随 \(n\) 单减,故由 \(K\) 小的酸 \(n\) 较大,故 \(K\) 小的酸需要更大的体积到达指定的 \(\xi\),故 \(c(\mathrm{H^+})\) 更大。
一些超纲东西
\(\mathrm dU = \delta Q + \delta W\)
\(H := U + pV\)
\(\Delta_f H_m^\theta\):标准摩尔生成焓。
\(\mathrm dS := \dfrac{\delta Q_R}{T}\),在可逆过程中。
\(\mathrm dS \geq \dfrac{\delta Q}{T}\)
绝热时,\(\delta Q = 0\),反应朝 \(\Delta S > 0\) 的方向移动。
在等温等压且系统不做外源功时:
\(T\mathrm dS \ge \delta Q = \mathrm dU - \delta W = \mathrm d(U + pV) = \mathrm dH\)
\(\Delta G := \Delta H - T\Delta S \le 0\),反应朝 \(\Delta G < 0\) 的方向移动。


 浙公网安备 33010602011771号
浙公网安备 33010602011771号