红花UGT鉴定与特征分析-文献精读142 - 指南
Identification and Characterization of CtUGT3 as the Key Player of Astragalin Biosynthesis inCarthamus tinctorius L.
CtUGT3 的鉴定与特征分析:红花 (Carthamus tinctorius L.) 中紫云英苷生物合成的关键因子

摘要
红花(Carthamus tinctoriusL.)是一种广泛分布的多用途经济作物。黄酮苷类是红花中的主要生物活性成分,但迄今仅鉴定出少量 UDP-糖基转移酶(UGT)。通过代谢组学和转录组分析,筛选出 3 个与 9 种黄酮O-糖苷积累相关的差异表达 UGT 基因。首次利用红花花冠原生质体体内验证了 UGT 候选基因的糖基化能力。结果表明,仅在CtUGT3过表达时,紫云英苷(astragalin)含量显著增加。此外,CtUGT3在体外表现出黄酮 3-OH 和 7-OH 的糖基化活性。分子建模和定点突变实验揭示,G15、T136、S276 和 E384 是CtUGT3关键的催化残基,对其糖基化能力至关重要。这些结果表明,CtUGT3具有黄酮 3-OH 糖基化特性,并参与红花中紫云英苷的生物合成。本研究为非模式植物黄酮生物合成相关基因研究提供了参考。
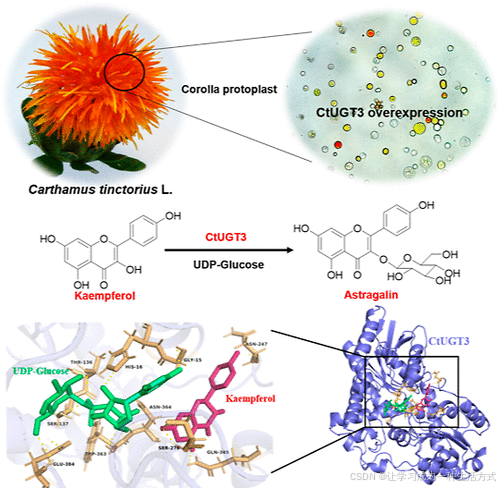
引言
红花(Carthamus tinctorius最常见的苷类之一。(5) 紫云英苷存在于许多植物中,具有多种生物活性,如抗肿瘤、抗炎、抗过敏、抗氧化和抗菌活性。(6)就是L.)是一种一年生菊科植物,是红花属唯一的栽培品种。红花是一种多用途的经济作物,广泛分布于全球。其种子用于生产食用油,花朵中提取的黄色和红色色素被广泛应用于食品、药物、化妆品等产品中。(1) 在东亚国家,红花花朵在传统医学中有着悠久的使用历史。红花花朵用于治疗多种疾病,如脑血管疾病、心血管疾病和妇科疾病。(2) 黄酮类化合物槲皮素是最常见的黄酮糖受体,通常在 3、6 或 7 位置与单糖或多个糖结合。(3,4) 在《中国药典》中,槲皮素经酸水解后的含量被视为红花药材的指示成分之一。槲皮素经酸水解后的含量反映了红花中所有槲皮素苷类的总量。红花中富含多种类型的槲皮素苷类,其中槲皮素 3-O-葡萄糖苷(紫云英苷)
黄酮类化合物的基本生物合成途径已广泛研究,特别是在模式植物中。(7) 在红花花朵中,许多参与黄酮生物合成的功能基因已被克隆并分析,包括 CHS、CHI、FLS 和 F3H。(8−12) 近年来,关于不同植物中的黄酮糖基转移酶(GTs)已有多项研究,包括 O-GTs、(13−15) C-GTs 和二-C-GTs。(16−20) 然而,目前在红花中只鉴定了两种 GTs,并且其功能仅在体外得到验证。(21,22) 因此,有必要在红花中筛选和鉴定新的糖基转移酶。
糖基化是重要的修饰反应,通常是天然产物生物合成的最终阶段,位于合成途径的下游,并与氢氧化、酰化和甲基化等反应协调。糖基化有助于植物次生代谢物生物合成的多样性和复杂性,并在植物防御和抗逆性中发挥关键作用。对于黄酮类化合物来说,它们通常在抵抗光胁迫中发挥重点作用。另一方面,研究发现温度、降水、光强和干旱胁迫会影响红花的生长、分布和次生代谢积累。(23−25) 光是调节植物生长和发育周期的重要环境因素。(26) 通常,蓝光、绿光和红光是对植物产量、生长和营养质量产生积极影响的主要光源。关于植物中的次生代谢,已有研究报道了红光、蓝光和紫外光对生物合成和积累的影响。(27−30) 然而,在特定情况下,其他光源也有益。因此,不同光质处理为筛选参与黄酮糖基化的基因提供了一种有效的方法。
本研究通过代谢组学和转录组分析,筛选出与黄酮糖苷含量相关的 UGT 候选基因,并利用不同光质处理的红花进行研究。首次利用红花花冠原生质体体内验证了 UGT 候选基因的黄酮O-糖基化能力。我们功能性地鉴定了CtUGT3并探索了其体外催化特性。我们的研究结果为黄酮O-糖基转移酶的催化机制提供了新的见解,并为非模式植物的黄酮生物合成基因研究给出了参考。
材料与方法
植物材料
红花 (Carthamus tinctoriusL.) 在植物生长室中培养。在实验前,植株在 25 °C 下以 15,000 lx 白光照射 12 小时/天,并在 18 °C 下处于黑暗环境,空气相对湿度设定为 65%。选取生长状态相同的红花植株,栽种于泥炭/蛭石/珍珠岩(3:1:1)的混合基质中。在开花前,将植株分为 6 组,每组包含等量的花蕾。开花过程持续 2 天。在开花期间,5 组植株分别在不同单色光(红光 664 nm、远红光 724 nm、蓝光 447 nm、UV-B 光 290 nm 和白光)照射 12 小时/天,最后 1 组植株保持黑暗处理。随后,收集盛开的花朵并存储于 -80 °C。除远红光处理组外,其他光照处理组的代谢组学和转录组分析均设置 3 个生物学重复,每个重复样本由 4 株植株混合而成。由于远红光处理组的花冠数量较少,该组样本由 12 株植株混合,并进行 3 次检测。
代谢物检测与定量
冻干花朵经混合研磨机(MM 400, Retsch)和氧化锆研磨珠以 30 Hz 研磨 1.5 分钟。称取 100 mg 粉末,在 4 °C 下用 0.6 mL 70% 甲醇水溶液提取过夜。以 10,000g 离心 10 分钟后,取上清液过滤,并使用 UPLC-ESI-MS/MS 系统(UPLC, Shim-pack UFLC SHIMADZU CBM30A;MS, Applied Biosystems 4500 Q TRAP)分析。
分析条件如下:
UPLC 色谱柱:Waters ACQUITY UPLC HSS T3 C18(1.8 μm, 2.1 mm × 100 mm)。
流动相:A 相(含 0.04% 乙酸的纯水),B 相(含 0.04% 乙酸的乙腈)。
梯度洗脱程序:
初始条件:95% A, 5% B;
10 分钟内梯度洗脱至 5% A, 95% B,并保持 1 分钟;
0.10 分钟内恢复至 95% A, 5% B,并保持 2.9 分钟。
色谱柱温度:40 °C
进样体积:4 μL
流出物经 ESI-三重四极杆线性离子阱(QTRAP)质谱检测。
代谢物鉴定和定量按照已有方法进行。(31) 代谢物鉴定基于一级和二级质谱数据,并通过以下公共数据库进行注释:MassBank (MassBank | MassBank of Mass Spectrometry Society of Japan Mass Spectral DataBase)、KNAPSAcK (KNApSAcK)、HMDB (Human Metabolome Database)、MoToDB (http://www.ab.wur.nl/moto/)、METLIN (http://metlin.scripps.edu/index.php)。代谢物定量采用多重反应监测(MRM)模式,所有注释代谢物的完整数据列于表 S8。
组间显著性差异代谢物的筛选标准为 VIP(变量重要性投影)≥ 1 且 Log2FC(倍数变化值)≥ 1。VIP 值由正交偏最小二乘判别分析(OPLS-DA)计算,该分析还包括得分图和置换检验图,并使用 R 语言包 MetaboAnalystR 生成。数据经对数变换(log2)并进行中心化处理后再进行 OPLS-DA 分析。采用 200 次置换检验防止过拟合。鉴定的代谢物通过 KEGG(Kyoto Encyclopedia of Genes and Genomes)化合物数据库注释,并映射到 KEGG 代谢通路数据库。显著变化的代谢物对应的代谢通路进一步进行代谢物集富集分析(MSEA),借助超几何检验计算 p 值评估显著性。
RNA 测序与注释
所有样本经液氮研磨,总 RNA 采用 TRIzol 试剂(Invitrogen, CA, USA)提取。DNA 去除步骤应用 Takara DNase(大连,中国)进行处理,按照制造商提供的标准协议操作。RNA 纯度经过 NanoPhotometer 检测 A260/A280 比值,所有样本的 A260/A280 比值均在 1.9–2.1 之间。RNA 完整性采用 Agilent 2100 Bioanalyzer 评估,仅选择无降解的样本进行后续分析。
共制备 16 个测序文库,包括远红光组的 1 个混合样本,以及其他 5 组处理的 3 个生物学重复样本。mRNA 通过磁珠与 oligo(dT) 引物结合进行富集,cDNA 由 cDNA 合成试剂盒(TaKaRa, 大连,中国)合成,并在两端连接测序接头。文库构建完成后,利用 Illumina HiSeq 4000 平台进行测序。测序数据经过质量控制后,与参考基因组(未发表)比对。Unigene 序列分别在 KEGG、NR、SwissProt、GO、KOG 和 TrEMBL 数据库中进行注释,氨基酸序列与 Pfam 数据库比对,并通过 HMMER 软件分析。原始数据已提交至 NCBI(PRJNA831043)。
差异表达基因(DEGs)分析
测序所得的 Clean Reads 采用 Bowtie 2 v2.2.5 (32) 映射至 Unigenes,基因表达水平运用 RSEM v1.2.12 (33) 计算。差异表达分析通过 DEseq2 (34,35) 进行,设定显著性筛选标准为倍数变化(Fold Change)≥ 2.00,调整后 p 值(adjusted P value)≤ 0.05。所有 DEGs 均通过 KEGG 和 Gene Ontology (GO) 进行富集分析。
实时荧光定量 PCR(RT-qPCR)分析
实时荧光定量 PCR (RT-qPCR) 按照已有方法进行。(24) 每个样本设 3 次重复。特异性引物由 Primer Premier 5 软件设计(表 S9)。采用 Bio-Rad CFX96 RT 环境(Bio-Rad, USA)和 SYBR Premix Ex TaqII(TaKaRa, Japan)检测基因表达水平。以 25S rRNA 作为内参基因,检测不同处理条件下的基因表达差异。RT-qPCR 循环条件如下:95 °C 预变性 3 min,随后 40 个循环,每循环包括 95 °C 10 s 和 61 °C 30 s。采用 2^−ΔΔCT 方法计算相对基因表达水平。(36) 数据统计分析采用 SPSS(v20),方差分析(ANOVA)结合 Tukey’s 检验进行显著性分析。成功扩增并验证的关键基因包括两条 PAL(苯丙氨酸解氨酶)基因、HCT(莽草酸O-羟基肉桂酰转移酶)基因、CHS(查尔酮合酶)基因、FLS(黄酮醇合酶)基因以及 3 条 UGT(UDP-糖基转移酶)基因,即CtPAL1、CtPAL2、CtHCT、CtCHS、CtFLS、CtUGT1、CtUGT2 和 CtUGT3。
分子克隆与框架进化分析
构建了一个包括不同光照处理 cDNA 的混合文库。利用 TRIzol 试剂提取总 RNA,并利用 cDNA 逆转录试剂盒(TaKaRa,日本)合成第一链 cDNA。基于第三代转录组测序资料获取了三个候选 UGT 基因的全长 CDS 序列。(37) 采用 Primer Premier 5.0 设计特异性引物(表 S9)。PCR 反应条件如下:95 °C 预变性 4 min;34 个循环(95 °C 30 s,58 °C 30 s,72 °C 2 min);最终延伸 72 °C 8 min。PCR 产物克隆至 pMD19-T 载体(TaKaRa,日本)。从 NCBI 下载不同 UGT 氨基酸序列,并使用 Geneious Prime 软件构建 UGT 系统进化树。
花冠原生质体的分离
原生质体的分离基于已有办法并进行了一些改进。(38,39) 取藏红花(C. tinctorius)嫩花冠,剪成 0.15 mm 小片,并转移至新鲜配制的酶解液 [1.5% 纤维素酶 RS(Yakult,日本)、0.3% 果胶酶 R-10(Yakult,日本)、0.5 M 甘露醇、10 mM MES、10 mM CaCl₂、0.1% 牛血清白蛋白(BSA)] 中,置于 50 mL 烧瓶中。酶溶液在 55 °C 预热 10 min 后加入 CaCl₂ 和 BSA。组织样品在 25 °C、40 rpm 振荡 3 h。随后,加入等体积的 W5 溶液(154 mM NaCl、125 mM CaCl₂、5 mM KCl、4 mM MES,pH 5.7),剧烈振荡 5 s 终止酶解。使用 40 μm 尼龙网过滤,滤液以 100g 离心 2 min。弃去上清液,将沉淀重悬于 5 mL 冷 W5 溶液中,并再以 100g 离心 1 min。重复该过程后,将原生质体置于冰上静置 30 min。最终弃去上清,调整原生质体浓度至 1 × 10⁵–1 × 10⁶/mL,并用 MMG(15 mM MgCl₂、0.5 M 甘露醇、4 mM MES,pH 5.7)悬浮。
CtUGTs 在花冠原生质体中的瞬时表达
CtUGTs 基因被克隆至 pA7-CaMV35S-YFP 载体中,以分析藏红花花冠原生质体的瞬时表达。原生质体转染参照文献方法,略作修改。(40) 取 100 μL 原生质体悬液,加入 10–20 μg 质粒,轻柔混匀。随后加入 110 μL PEG 溶液(40% PEG4000、0.2 M 甘露醇、100 mM CaCl₂),轻柔混匀,置于 25 °C 孵育 15 min。接着,加入 440 μL W5 终止转染,以 100g 离心 2 min,弃去上清液,并重悬于 1 mL MMG 中。黑暗条件下孵育 12 h 后用于实验分析。
收集细胞后,称取 20 mg 原生质体,以 5 mL 水 60 °C 提取 45 min。利用 UPLC-QTOF-MS/MS(QTOF = 三重四极杆飞行时间质谱)检测,采用 Eclipse Plus C18 色谱柱(150 mm × 3.0 mm,1.8 μm,Agilent,美国),流动相为乙腈和 0.1% 甲酸水溶液(v/v)。采用线性梯度 HPLC 洗脱代码:0 min 5% 乙腈,25 min 95% 乙腈。利用提取离子色谱(EICs)比对商品标准品,筛选差异代谢的黄酮糖苷。空载体 pA7 转染的原生质体作为阴性对照。
重组蛋白的表达与纯化
将三种 UGT 基因克隆至 pLATE52 载体(Thermo Fisher,美国)进行原核表达分析。pLATE52-CtUGT 重组载体转化 BL21(DE3)菌株,并采用热激法转化。BL21 菌株在 37 °C、200 rpm 摇床中培养至 OD600 = 0.5,随后置于冰上 10 min,加入 120 μM IPTG(异丙基-β-d-1-硫代半乳糖苷)诱导,16 °C、200 rpm 继续培养 16 h。
细胞通过离心(6517g,4 °C,15 min)收集,弃去上清液。细胞沉淀重悬于 30 mL 裂解缓冲液(25 mM HEPES pH 8、500 mM NaCl、5 mM 吡唑),超声裂解,4 °C 离心(12516g,45 min),滤过 0.45 μm 滤膜。Ni-NTA 树脂(Qiagen)按 1.5 mL/L 细胞培养液比例加入滤液,4 °C 震荡 1 h。蛋白-树脂混合液经重力流动柱加载,弃去流穿液。使用约 30 mL 洗脱缓冲液(25 mM HEPES pH 8、100 mM NaCl、20 mM 吡唑)洗涤,并以 25 mM HEPES pH 8、100 mM NaCl、250 mM 吡唑洗脱蛋白。布拉德福德(Bradford)试剂检测蛋白浓度。CtUGTs 通过 30 kDa Amicon 超滤离心浓缩,加入 10%(v/v)甘油,液氮速冻,-80 °C 保存。
酶活性分析
在 100 μL 反应体系中,0.5 mM 尿苷二磷酸葡萄糖(UDP-Glc)与 0.2 mM 底物(1)橙皮素、(2)橙皮素查尔酮、(3)芹菜素、(4)山奈酚、(5)槲皮素、(6)异鼠李素,在 50 mM NaH₂PO₄-Na₂HPO₄ 缓冲液(pH 8.0)中加入 10 μM 纯化的 CtUGTs,于 30 °C 反应 30 min。以 100 °C 沸腾 10 min 失活的蛋白作为阴性对照。反应产物加入 200 μL 冰冷甲醇(MeOH)终止,12000 rpm 离心 20 min。上清液通过 UPLC-QTOF-MS/MS 分析,如上所述。糖基化产物经过核磁共振(NMR)或与商品标准品比对进行鉴定。转化率基于糖基化产物和底物的标准曲线计算峰面积。
橙皮素查尔酮 2′-O-葡萄糖苷(2a):MS m/z: 435.1285 [M + H]+; 1H NMR(CD3OD,600 MHz):δ 8.03(1H,d,J = 16.0 Hz,H-α),7.68(1H,d,J = 16.0 Hz,H-β),7.61(2H,d,J = 8.5 Hz,H-2,6)……(数据省略)。(41)
CtUGT3 的生化性质和动力学参数测定
利用 1 mM 橙皮素 (1) 作为糖受体,2 mM UDP-Glc 作为糖供体,在 100 μL 反应体系中加入 10 μM 纯化蛋白,研究 CtUGT3 的生化性质。为确定 CtUGT3 的最佳反应时间,分别设定 1、2、5、10、20、30、60 和 120 min 的反应时间进行实验。为确定 CtUGT3 的最适 pH,实验在不同 pH 缓冲体系中进行,包括 pH 4.0–6.0(50 mM 柠檬酸–柠檬酸钠缓冲液)、pH 6.0–8.0(50 mM Na₂HPO₄–NaH₂PO₄ 缓冲液)、pH 7.0–9.0(50 mM Tris–HCl 缓冲液)和 pH 9.0–11.0(50 mM Na₂CO₃–NaHCO₃ 缓冲液)。通过在不同温度(4、16、25、37、45、50、60 和 70 °C)下孵育反应体系,优化 CtUGT3 的最适反应温度。为分析 CtUGT3 活性对二价金属离子的依赖性,在反应体系中分别加入 5 mM 的 Ca²⁺、Co²⁺、Fe²⁺、Mg²⁺、Mn²⁺、Zn²⁺ 和 EDTA 进行测试。每种条件下均进行三次平行实验。反应终止后,加入冰冷甲醇(MeOH),12000 rpm 离心 20 min,上清液经 HPLC 分析。
为测定 CtUGT3 对橙皮素的动力学参数,实验体系包含 50 mM Na₂HPO₄–NaH₂PO₄(pH 8.0)、1 μM CtUGT3、过量 UDP-葡萄糖,以及不同浓度(5、10、20、40、80、100、200、400、800、1000 和 1500 μM)的橙皮素,在 37 °C 反应 5 min,总体积 100 μL。
为测定 CtUGT3 对芹菜素的动力学参数,实验体系与橙皮素相同,仅底物更换为不同浓度(5、10、20、40、80、100、200、400、800、1000 和 1500 μM)的芹菜素。
为测定 CtUGT3 对山奈酚的动力学参数,实验体系同上,仅底物更换为不同浓度(100、200、400、800、1000、1200、1600、1800、2000 和 2400 μM)的山奈酚。
为测定 CtUGT3 对山奈酚 7-O-葡萄糖苷的动力学参数,实验体系同上,仅底物更换为不同浓度(5、10、20、40、80、100、200、400、600、800 和 1200 μM)的山奈酚 7-O-葡萄糖苷。
为测定 CtUGT3 对 UDP-葡萄糖的动力学参数,实验体系包含 50 mM Na₂HPO₄–NaH₂PO₄(pH 8.0)、1 μM CtUGT3、过量橙皮素,以及不同浓度(1、2.5、5、10、20、40、80、100、200 和 400 μM)的 UDP-葡萄糖,在 37 °C 反应 5 min,总体积 100 μL。
所有实验均进行三次平行重复,反应终止后加入冰冷 MeOH,12000 rpm 离心 10 min,上清液经 HPLC 分析。Km 值基于米氏方程 (Michaelis–Menten) 曲线计算。
分子对接与定点突变
利用 AlphaFold(AlphaFold Protein Structure Database)构建 CtUGT3 蛋白模型。使用 AutoDock Vina(版本 1.2.5)进行 CtUGT3 与山奈酚及 UDP-葡萄糖的分子对接。(42,43) 选取最低结合能的复合物结构进行后续研究。
凭借定点突变构建目标突变体,以 CtUGT3 野生型表达质粒为 PCR 模板,应用 PrimeSTAR Max Premix(2×)(TaKaRa,日本)进行 PCR,简并引物见表 S10。PCR 反应条件如下:95 °C 1 min;30 个循环(95 °C 10 s,68 °C 5 s,72 °C 30 s);72 °C 终延伸 2 min。经测序验证的突变体转化至大肠杆菌 BL21(DE3),进行重组蛋白的异源表达与纯化,方法同上。CtUGT3 突变体的酶活性测定方法与野生型相同,糖基化产物和底物的标准曲线计算转化率。
结果
不同光质处理下红花样品的黄酮类代谢物及转录组分析
比较了在蓝光(Bl)、远红光(FR)、红光(Re)和 UV-B(UV)处理下的四组红花样品,与白光(Wh)及黑暗(Dr)条件下培养的红花样品的黄酮类代谢物的差异。共检测到 114 种黄酮类代谢物(表 S1),其中 32 种代谢物表现出显著差异(表 S2)。
与白光相比,远红光、UV-B 和黑暗条件下的红花黄酮类代谢物差异最大。与黑暗条件相比,远红光和 UV-B 处理的红花样品表现出最显著的黄酮类代谢物差异(图 1A)。
32 种差异代谢黄酮归属于 7 种次级代谢分类,包括黄烷醇、黄酮碳苷、异黄酮、黄酮、黄酮醇、橙黄素类黄酮和二氢黄酮。其中,黄酮醇和黄酮类的差异代谢物最多,分别有 11 种和 9 种(图 1B)。此外,32 种差异黄酮中有 18 种为糖苷,包括 15 种 O-糖苷和 3 种 C-糖苷。这些糖苷的大部分苷元具有黄酮醇或黄酮结构。32 种差异代谢黄酮的结构见图 S1。

图 1. 不同光质条件下培养的红花黄酮类代谢物差异
(A) 黄酮类及其他类型的差异代谢物数量。 (B) 7 个黄酮类亚类的差异代谢物数量。
x 轴表示不同的光照条件,y 轴表示差异代谢物的数量。Wh、Bl、FR、Re、UV 和 Dr 分别代表白光、蓝光、远红光、红光、UV-B 光和黑暗条件下处理的红花样品。
光照条件对比说明:
Wh_vs_Bl:蓝光处理组与白光处理组的比较
Wh_vs_FR:远红光处理组与白光处理组的比较
Wh_vs_Re:红光处理组与白光处理组的比较
Wh_vs_UV:UV-B 处理组与白光处理组的比较
Wh_vs_Dr:黑暗条件处理组与白光处理组的比较
Dr_vs_Bl:蓝光处理组与黑暗处理组的比较
Dr_vs_FR:远红光处理组与黑暗处理组的比较
Dr_vs_Re:红光处理组与黑暗处理组的比较
Dr_vs_UV:UV-B 处理组与黑暗处理组的比较
转录组分析
通过转录组分析,共获得 121 GB 的高质量数据。每个样本的 Q30 值均大于 91%,内容质量指标见表 S3。超过 95% 的清洁 reads(Clean Reads)成功比对到参考基因组(表 S4)。
根据基因表达水平,共鉴定出 1269 个差异表达基因(DEGs)(表 S5)。与白光或黑暗条件相比,远红光(FR 组)处理下的 DEGs 数量最多,其次是 UV 组(表 S6)。
其中,8 个 DEGs 被注释到黄酮类生物合成途径,包括 2 个苯丙氨酸解氨酶 (PAL)、1 个查尔酮合酶 (CHS)、1 个乙酰辅酶 A 转移酶 (HCT)、1 个黄酮醇合酶 (FLS) 和 3 个 UDP-糖基转移酶 (UGTs),分别命名为 CtPAL1、CtPAL2、CtCHS、CtHCT、CtFLS、CtUGT1、CtUGT2 和 CtUGT3。
利用 RT-qPCR 验证了 8 个 DEGs 的表达水平,结果与 RNA-Seq 数据一致(图 S2),表明测序数据的准确性。
UGT 基因在不同光照条件下的表达变化:
CtUGT1在蓝光和 UV 处理下表达上调,在远红光下表达下调。
CtUGT2在蓝光和红光下表达上调,在黑暗条件下表达下调。
CtUGT3在蓝光下表达上调,在远红光和黑暗条件下表达下调(图 2)。
通过筛选与这三个差异表达的 UGT 基因显著相关的黄酮糖苷,最终发现 9 种黄酮糖苷的含量与 CtUGT1、CtUGT2 和 CtUGT3 的表达水平显著相关,主要为黄酮醇的3-O-糖苷 和 7-O-糖苷(表 1)。

图 2. 与黄酮类生物合成途径相关的 8 个差异表达基因的相对表达水平
PAL 代表苯丙氨酸解氨酶 (phenylalanine ammonia-lyase); HCT 代表莽草酸 O-羟基肉桂酰转移酶 (shikimate O-hydroxy cinnamoyltransferase); CHS 代表查尔酮合酶 (chalcone synthase); FLS 代表黄酮醇合酶 (flavonol synthase); UGT 代表 UDP-糖基转移酶 (UDP glycosyltransferase)。
Wh、Bl、FR、Re、UV 和 Dr 分别代表白光、蓝光、远红光、红光、UV-B 光和黑暗条件下处理的红花样品。
able 1. Significantly Correlated Differentially Expressed Genes and Metabolites
| genes | compounds | type | correlation |
|---|---|---|---|
| CtUGT1 | diosmetin 7-O-glucuronide | flavone | positive |
| kaempferol 7-O-glucoside | flavonol | positive | |
| trifolin (kaempferol 3-O-galactoside) | flavonol | positive | |
| astragalin (kaempferol 3-O-glucoside) | flavonol | positive | |
| luteolin 7-O-glucoside | flavone | positive | |
| quercetin 7-O-glucoside | flavonol | positive | |
| isorhamnetin 3-O-rutinoside | flavonol | negative | |
| quercetin 3-O-robinobioside | flavonol | negative | |
| CtUGT2 | luteolin 7-O-glucoside | flavone | positive |
| isorhamnetin 3-O-glucuronide | flavonol | positive | |
| CtUGT3 | kaempferol 7-O-glucoside | flavonol | positive |
| trifolin (kaempferol 3-O-galactoside) | flavonol | positive | |
| astragalin (kaempferol 3-O-glucoside) | flavonol | positive | |
| luteolin 7-O-glucoside | flavone | positive | |
| quercetin 7-O-glucoside | flavonol | positive | |
| isorhamnetin 3-O-glucuronide | flavonol | positive | |
| isorhamnetin 3-O-rutinoside | flavonol | negative | |
| quercetin 3-O-robinobioside | flavonol | negative |
UGT 候选基因的克隆与生物信息学分析
三种差异表达的 UGT 基因的全长编码序列分别被克隆,长度分别为 1425 bp、1431 bp 和 1425 bp(GenBank 登录号:OQ354214、OQ354222 和 OQ354223)。其预测的分子量、等电点 (pI)、消光系数和疏水性指数列于表 S7。
系统发育分析表明,这三个 UGT 候选基因与 GT04F14、TcCGT1、PlUGT43 和 UGT71E5 具有较高的亲缘关系。其中:
GT04F14可催化异黄酮的7-OH 羟基进行糖基化 (44);
TcCGT1 兼具 C-糖基化和 O-糖基化活性,可作用于多种黄酮类底物 (45);
PlUGT43 具有 C-糖基转移酶 (C-GT) 功能,可催化异黄酮糖基化 (46);
UGT71E5 具有高效的 O-糖基化催化活性,主要作用于黄酮类化合物 (47)。
因此,推测候选CtUGTs可能具有与同一进化分支中酶类似的功能(图 3)。

图 3. UGTs 的系统发育分析
三种 CtUGTs 与其他已报道的 UGT 进行了比对。系统发育树采用Geneious Prime 软件,通过邻接法 (neighbor-joining method) 进行构建(使用 1000 次自举重复)。用于比对的 UGTs 物种名称及其 GenBank 登录号如下:
AbCGT(MN747045.1, Aloe vera)
ChCGT(LC131335.1, Citrus hanaju)
CuCGT(A0A224AKZ9, Citrus unshiu)
FaGT7(Q2 V6J9, Fragaria × ananassa)
FcCGT(A0A224AM54, Citrus japonica)
FeCGT(AB909375.1, Fagopyrum esculentum)
FeCGTb(A0A0A1H7N4, Fagopyrum esculentum)
gilGT(AY233211.2, Streptomyces griseoflavus)
GgCGT(MH998596, Glycyrrhiza glabra)
GmCGT(LC003312.1, Glycine max)
GmUGT3(AB904892.1, Glycine max)
GmUGT7(NM_001317558.2, Glycine max)
GmUGT8(NM_001292092.1, Glycine max)
GmUGT9(AB904896.1, Glycine max)
GT04F14(HQ219042.1, Pueraria montana var. lobata)
Gt5GT7(B2NID7, Gentiana trifloral)
GtUF6CGT1(A0A0B6VIJ5, Gentiana trifloral)
MiCGT(XP_044491083, Mangifera indica)
MiCGTb(KT989668.1, Mangifera indica)
OSCGT(C3W7B0, Oryza sativa)
OsUGT706C2(DP000009.2, Oryza sativa)
PfA5GT(Q9ZR27.1, Perilla frutescens var. crispa)
PgUGT95B2(MH507175.1, Punica granatum)
PlUGT2(A0A172J2D0, Pueraria montana var. lobata)
PlUGT43(A0A172J2G3, Pueraria montana var. lobata)
Ih3GT(AB161175.1, Iris hollandica)
Ih5GT(AB113664.1, Iris hollandica)
IroB(NC_003197.2, Salmonella enterica)
Sb3GT1(MK577650.1, Scutellaria baicalensis)
SlUGT75C1(NM_001361345.1, Solanum lycopersicum)
SsfS6(GQ409537.1, Streptomyces sp. SF2575)
TcCGT1(PRJNA532685, Trollius chinensis)
TwCGT3(MN165635.1, Tripterygium wilfordii)
UGT71E5(KX610759.1, Carthamus tinctorius)
UGT73A4(Q40286, Manihot esculenta)
UGT73AE1(KJ956788.1, Carthamus tinctorius)
UGT73C6(NP_181217, Arabidopsis thaliana)
UGT73J1(AY262063.1, Allium cepa)
UGT78D1(NM_102790.4, Arabidopsis thaliana)
UGT78D2(NM_121711.5, Arabidopsis thaliana)
UGT78G1(XM_003610115.4, Medicago truncatula)
UGT78K1(GU434274.1, Glycine max)
UGT89C1(Q9LNE6, Arabidopsis thaliana)
UGT95A1(EU561020.1, Hieracium pilosella)
UrdGT2(AF164960.1, Streptomyces fradiae)
VhA5GT(Q9ZR25.1, Verbena hybrida)
VvGT6(NM_001280903.1, Vitis vinifera)
VvGT5(AB499074.1, Vitis vinifera)
VvGT1(NP_001384786.1, Vitis vinifera)
WjGT1(LC465149.1, Eutrema japonicum)
ZmCGT(NCVQ01000007.1, Zea mays)
CtUGT3 在红花花冠原生质体中的瞬时表达
红花含有一些特殊的黄酮类化合物,如羟基红花黄色素 A (HSYA),其主要为 查耳酮 C-糖苷。然而,常用于作用鉴定的模式植物可能不含这些化合物或其前体。因此,红花花冠原生质体是验证 红花黄酮生物合成相关功能基因的理想体系。
实验成功从红花嫩花冠中分离出了原生质体,并构建了pA7-CaMV35S-CtUGT3-YFP 载体,随后将其转化至花冠原生质体中。红花花冠原生质体含有浅黄色细胞,在 480–490 nm 激发波长下能够发出绿色或黄绿色荧光。
为了区分荧光标记蛋白,实验选用黄荧光蛋白 (YFP),其可在不同波长下发出绿光、黄光或红光。此外,还选择DsRed (558 nm) 作为荧光显微镜的观测波长。
野生型 (WT) 细胞在 DsRed 下不显示荧光;
成功瞬时表达 YFP 标签的细胞在 DsRed 下呈现红色荧光;
因此,在 DsRed 通道下检测 YFP 能有效区分红花原生质体的自发荧光和瞬时表达的荧光标记蛋白。
结果表明,在成功转化CtUGT1、CtUGT2 和 CtUGT3的原生质体中,DsRed 通道下出现明显的红色荧光,且部分细胞颜色从透明或浅黄色变为深黄色,甚至红色(图 4)。
这一结果表明,CtUGTs 的瞬时表达可能影响原生质体中黄酮类化合物的积累。

图 4. CtUGTs 在红花花冠原生质体中的瞬时表达
CK:未转染组(对照组)。
pA7-YFP:转染空载体的实验组。
pA7-CtUGTs-YFP:转染带有 CtUGT 基因载体的实验组。
Bright:明场光照下拍摄的图像。
GFP:在 488 nm 波长下拍摄的荧光图像。
DsRED:在 558 nm 波长下拍摄的荧光图像。
红花原生质体中黄酮苷的测定
采用 UPLC-QTOF-MS/MS 对 红花原生质体中的黄酮苷进行测定,并利用市售标准品鉴定出 6 个关键峰:
6-羟基山奈酚 3,6-O-双葡萄糖苷-7-O-葡萄糖醛酸(HKDG)
6-羟基山奈酚 3,6,7-O-三葡萄糖苷(HKTG)
羟基红花黄色素 A(HSYA)
脱水红花黄色素 B(AB)
山奈酚 3-O-芸香糖苷(K3OR)
芒柄花苷(山奈酚 3-O-葡萄糖苷)(Astragalin)
实验结果表明:当 CtUGT3 在原生质体中过表达时,HKDG 含量下降,而 芒柄花苷 (Astragalin) 含量增加至两倍以上(图 5)。
此外,其他化合物的浓度也有所变化,但差异不显著。
这一结果表明,CtUGT3 在红花中具有 3-O-糖基化 (3-O-glycosylation) 活性,并参与芒柄花苷的生物合成。

图 5. CtUGTs 瞬时表达后花冠原生质体中 UGTs 的相对表达量及 6 种黄酮苷的含量
(A) CtUGT1、CtUGT2 和 CtUGT3 在 5 个不同实验组中的相对表达量。 (B) 花冠原生质体中的 6 种黄酮苷:
HKDG(6-羟基山奈酚 3,6-O-双葡萄糖苷-7-O-葡萄糖醛酸)
HKTG(6-羟基山奈酚 3,6,7-O-三葡萄糖苷)
HSYA(羟基红花黄色素 A)
AB(脱水红花黄色素 B)
K3OR(山奈酚 3-O-芸香糖苷)
Astragalin(芒柄花苷,山奈酚 3-O-葡萄糖苷)
实验组说明:
CK:未转染组(对照组)
pA7-vector:转染空载体的实验组
CtUGT1、CtUGT2、CtUGT3:分别瞬时表达 CtUGT1、CtUGT2 和 CtUGT3 的花冠原生质体样本
实验重复:每组进行了 3 个生物学重复。图中部分显著性差异标记为 *P < 0.05,**P < 0.01。
酶活性验证
重组 UGTs 蛋白的表达与纯化
CtUGT1、CtUGT2 和 CtUGT3在 BL21 (DE3) 菌株中成功表达,并通过 His 标签纯化(图 S9)。
底物筛选
选取红花花中常见的黄酮苷元(糖受体)检测酶活性,包括:
山奈酚 (Kaempferol)、芹菜素 (Apigenin)、槲皮素 (Quercetin) 和 异鼠李素 (Isorhamnetin)
另外选择 柚皮素 (Naringenin) 和 柚皮素查尔酮 (Naringenin chalcone),因其是黄酮生物合成的关键节点,且红花中含有大量查尔酮类化合物
UDP-葡萄糖 (UDP-glucose) 作为糖供体
CtUGT3 的催化特性
CtUGT3 可催化所有底物,并表现出比其他两个 UGT 更强的糖基化活性。
当 柚皮素 (1)作为受体底物时,CtUGT3催化形成柚皮素 7-O-葡萄糖苷 (1a)(图 S12)。
当 柚皮素查尔酮 (2)作为受体底物时,CtUGT3催化形成两个具有相同分子量的糖基化产物:
柚皮素查尔酮 2'-O-葡萄糖苷 (2a)
1a(图 S13)
查尔酮与柚皮素的互变现象
柚皮素查尔酮 (2) 和 柚皮素 (1)互为异构体,前者在水溶液中可闭环转变为柚皮素,而柚皮素在强碱环境下也可开环转变为柚皮素查尔酮。
UV 吸收光谱区分两者:
柚皮素 (1) 和 1a的最大 UV 吸收在280 nm 左右
柚皮素查尔酮 (2) 和 2a的最大 UV 吸收在360 nm 左右
这一区别可简单区分查尔酮与二氢黄酮
其他糖基化产物
CtUGT3 还可催化其他黄酮苷元:
芹菜素 (3) → 芹菜素 7-O-葡萄糖苷 (3a)(图 S14)
山奈酚 (4) → 三种产物:
山奈酚 7-O-葡萄糖苷 (4a)
山奈酚 3-O-葡萄糖苷 (4b)
山奈酚 3,7-二-O-葡萄糖苷 (4c)(图 S15)
槲皮素 (5) 和异鼠李素 (6)也产生了多种糖基化产物(图 S16、S17)。
催化优先性
进一步研究发现,CtUGT3 能催化 4a 转化为 4c,但难以催化 4b 转化为 4c,说明其对不同位点的糖基化有一定的选择性。
不同黄酮苷元的糖基化转化率如图 6 所示。

图 6. CtUGT3 催化黄酮苷元的转化率
化合物编号:
1:柚皮素 (Naringenin)
3:芹菜素 (Apigenin)
4:山奈酚 (Kaempferol)
4a:山奈酚 7-O-葡萄糖苷 (Kaempferol 7-O-glucoside)
4b:山奈酚 3-O-葡萄糖苷 (Kaempferol 3-O-glucoside)
5:槲皮素 (Quercetin)
6:异鼠李素 (Isorhamnetin)
每个反应重复 3 次。
CtUGT3 的生化性质及动力学参数分析
酶促反应优化
以 柚皮素 (1)作为糖受体,UDP-葡萄糖为糖供体,优化 CtUGT3 的生化条件(图 S18):
最佳温度范围:37–50°C
反应时间:前 5 分钟反应最剧烈,60 分钟 基本完成
二价金属离子:除 Co²⁺ 具有抑制作用外,其他金属离子对 CtUGT3 活性无明显影响
最佳 pH:pH 8(Na₂HPO₄–NaH₂PO₄ 缓冲液)
动力学参数分析
米氏常数 (Km) 及催化效率 (Kcat/Km)(图 S19):
UDP-葡萄糖饱和条件下,Km 值 (μM):
1(柚皮素):70.16
3(芹菜素):75.46
4(山奈酚):110.40
4a(山奈酚 7-O-葡萄糖苷):39.70
Kcat/Km 值 (M⁻¹·s⁻¹):
1(柚皮素):999.2
3(芹菜素):2207.5
4(山奈酚):4116.8
4a(山奈酚 7-O-葡萄糖苷):2537.2
尽管 Km 值表明 CtUGT3 对山奈酚的亲和力较弱,但其催化山奈酚的效率最高 (Kcat/Km 最高)。
CtUGT3 活性位点分析(自对接及定点突变)
活性位点预测
采用自对接分析 (Autodocking),筛选与 山奈酚 (Kaempferol) 和 UDP-葡萄糖发生相互作用的10 个氨基酸残基(图 7A):
与山奈酚形成氢键:Asn247、Ser276、Gln345
同时与 UDP-葡萄糖结合的残基:Gly15、His16、Thr136、Ser137、Asn247、Ser276、Gln345、Trp363、Asn364、Glu384
序列比对
CtUGT3 与其他 UGT 进行比对,发现以下 6 个氨基酸高度保守(图 S20):
His16、Ser276、Gln345、Trp363、Asn364、Glu384
3-O-糖基转移酶 (3-O-GT) Sb3GT1也进行了比对,因为 CtUGT3 体内表现出3-O-糖基化能力。
关键位点突变实验
构建 6 种CtUGT3 突变体,并催化山奈酚:
G15T
T136P
S137G
N247S
S276T
E384D
纯化的 6 种重组突变蛋白如图 S21 所示。
突变体催化结果(图 7B)
G15T:糖基转移酶活性降低
T136P:主要生成 7-O-糖基化产物,而非 3-O-糖基化产物
S276T & E384D:3-O-糖苷含量明显高于野生型
进一步验证(图 7C)
以 山奈酚 7-O-葡萄糖苷为底物,分析突变体的 3-O-糖基化能力:
G15T 和 T136P 仅产生少量 山奈酚 3,7-二-O-葡萄糖苷
S276T 和 E384D明显增加 了 3,7-二-O-葡萄糖苷 的产量
结论
S276T 和 E384D 具有更强的 3-O-糖基化能力
CtUGT3 糖基化活性的重要残基就是G15、T136、S276 和 E384

图 7. CtUGT3 及其突变体催化杨梅素及其 7-O-葡萄糖苷的分子建模与转化率(A) CtUGT3 与杨梅素及 UDP-葡萄糖的结合模型;杨梅素标记为红色,UDP-葡萄糖标记为绿色,与配体相互作用的残基标记为黄色; (B) CtUGT3 及其突变体催化杨梅素的转化率; (C) CtUGT3 及其突变体催化杨梅素 7-O-葡萄糖苷的转化率。 每个样品均进行三次重复。G15T、T136P、S276T 和 E384D 的转化率与 CtUGT3 野生型存在显著差异,图中标注了统计显著性(*P < 0.05)。
讨论
红花花瓣中含有特殊的黄酮类化合物,如查尔酮 C-糖苷,代表性成分为羟基红花黄色素 A(HSYA),其是影响红花花色的主要成分,而非花青素。然而,常用于功能鉴定的模式植物可能不含这些成分或其前体,而且大多数药用植物仍缺乏转基因系统,这极大地限制了活性成分生物合成及调控的分子机制研究。原生质体已被广泛应用于亚细胞定位、基因表达分析、蛋白质相互作用、基因编辑等研究领域。
由于红花的活性成分仅存在于花瓣中,本研究建立了红花花冠的原生质体系统,为进一步解析红花及其他药用或园艺植物花瓣中活性成分的生物合成提供了参考。在成功转化 CtUGT3 的原生质体中,DsRed 标记下观察到明显的红色荧光,细胞颜色也加深。同时,在原生质体中鉴定出了红花中最常见的查尔酮、杨梅素及其糖苷(如 HSYA、AB 和杨梅苷),其中杨梅苷(杨梅素 3-O-葡萄糖苷)含量显著增加。然而,在原生质体中仅检测到杨梅素糖苷,而未检测到槲皮素和异鼠李素等其他黄酮醇的糖苷。这可能是因为杨梅素是红花中最丰富的黄酮醇,并且本研究使用的新鲜未开放花冠制备原生质体,而代谢组学研究使用的是开放的花朵,导致其化学成分存在一定差异。此外,尽管 CtUGT3 在体外表现出 3-OH 和 7-OH 糖基化活性,但在花冠原生质体中未检测到任何 7-O-糖苷含量的显著变化。结果表明,CtUGT3 在红花花瓣中确实具有黄酮类 O-糖基化活性,尤其是杨梅素 3-OH 糖基化能力。同时,研究结果也证明了红花花冠原生质体是验证红花中参与黄酮生物合成的糖基转移酶(GT)的理想材料。
第一个被鉴定出的 GT,能够催化多种受体生成 N-、O- 或 S-糖苷。随后,又发现了 UGT71E5,可催化槲皮素、柚皮素、染料木素和根皮苷形成二-O 或多-O-葡萄糖苷。然而,大多数药用或可食用植物中的 GT 仅在体外被鉴定,其在体内的真实作用可能与体外实验有所不同。就是植物中的大多数黄酮类化合物以糖苷形式存在,其中最丰富的黄酮糖苷类型包括黄酮 O-或 C-糖苷以及黄酮醇 O-糖苷,而 O-糖苷主导发生在 3 位或 7 位。例如,Scutellaria baicalensis 中的 Sb3GT1 是一种 3-O-糖基转移酶,能 3-O-糖基化 17 种黄酮醇苷元,并可接受五种不同的糖供体(UDP-Glc/-Gal/-GlcNAc/-Xyl/-Ara)。在莲子胚中鉴定出的 NpUGT6 具有催化槲皮素 3-OH 糖基化的活性。此外,7-O-糖基转移酶(7-O-GT)也是一种常见的酶,如从茶树中鉴定出的 CsUGT75L12 参与苦味化合物的生物合成;鸢尾 UGT73CD1 具有广泛的催化能力,可催化 12 种黄酮类化合物及 3,4-二氯苯胺形成 O-或 N-糖苷。而大多数糖基转移酶(GT)具有较宽的底物适应性,并且有些 GT 可在不同底物上催化不同位置的糖基化。例如,Tripterygium wilfordii 中的 TwUGT3 可接受木犀草素、槲皮素、松柏苷和染料木素,并分别生成木犀草素 7-O-葡萄糖苷、槲皮素 3-O-葡萄糖苷、松柏苷 7-O-葡萄糖苷和染料木素 4′-O-葡萄糖苷。在红花中,UGT73AE1
本研究表明,CtUGT3 可催化黄酮(芹菜素)、二氢黄酮(柚皮素)、黄酮醇(杨梅素、槲皮素和异鼠李素)及查尔酮(柚皮素查尔酮)生成相应的 O-糖苷。在体外实验中,当黄酮醇作为苷元时,CtUGT3 同时表现出 3-OH 和 7-OH 糖基化活性。具体而言,CtUGT3 可催化杨梅素及其 7-O-糖苷生成 3,7-二-O-糖苷,但较难催化 3-O-糖苷进一步生成 3,7-二-O-糖苷。然而,当 CtUGT3 在花冠细胞中过表达时,仅观察到杨梅苷(杨梅素 3-O-糖苷)含量的显著增加,而 7-O-糖苷或 3,7-二-O-糖苷的含量未见明显上升。此外,虽然 CtUGT3 对杨梅素的亲和力(Km 值)较弱,但其催化杨梅素的效率(Kcat/Km 值)最高。这表明 CtUGT3 可能在体内与其他酶存在竞争或协同作用,导致其体内功能与体外实验结果存在差异。
为了进一步解析 CtUGT3 的催化机制,本研究进行了分子对接及定点突变实验。GgCGT 中的 T145 和 D390 分别对应 CtUGT3 中的 T136 和 E384,研究发现糖供体选择性受 T145、D390 及其他残基与糖羟基的氢键相互作用控制。此外,Sb3GT1 中的 T16 和 T281 分别对应 CtUGT3 中的 G15 和 S276,前者被认为可稳定糖供体。本研究中,G15 与 UDP-葡萄糖相互作用,其突变体 G15T 的糖基化活性降低,而 S276 通过氢键与杨梅素 7-OH 结合,而非直接与糖供体结合。根据 CtUGT3 在体外的酶活性测定结果,我们推测当 CtUGT3 催化杨梅素时,7-OH 糖基化可能与 3-OH 糖基化竞争,从而导致 S276T 突变体降低 7-OH 糖基化活性,并提高 3-OH 糖基化产物的生成量。
总的来说,本研究鉴定并验证了 CtUGT3 作为黄酮 3-OH 糖基化酶的功能,并揭示了其催化机制,为非模式植物中黄酮生物合成基因的研究提供了参考。





 浙公网安备 33010602011771号
浙公网安备 33010602011771号