[综述阅读] Structural Mechanisms of NLRP3 Inflammasome Assembly and Activation
Structural Mechanisms of NLRP3 Inflammasome Assembly and Activation
文献来自 Annu. Rev. Immunol. 2023. 41:301–16
引言:自我与非自我、有害与无害
作为第一道防线,先天免疫系统通过检测微生物感染或内源性细胞损伤的威胁信号来不断调查环境。它被称为先天性,因为感应机制是种系编码的,在病原体入侵之前就已经存在了。先天免疫的检测机制最初被提出为模式识别,其中微生物中保守的分子,如病毒核酸、细菌脂多糖(LPS)和鞭毛蛋白,被模式识别受体(PRRs)识别,以提醒免疫系统。这些保守的常见微生物分子统称为病原体相关分子模型(PAMPs),而从受损或垂死细胞释放的分子构成了损伤相关分子模型(DAMPs)。模式识别的概念先于第一个PRR的识别,提供了一种区分自我和非自我的方法,并很好地预测了随后识别的细胞表面Toll样受体(TLR)会识别什么
然而,随着越来越多的细胞内先天免疫受体被鉴定出来,很明显,并非所有这些受体都与保守的 PAMP 或 DAMP 直接相互作用。相比之下,先天免疫受体通常通过检测 PAMP 或 DAMP 引起的细胞变化来间接感知危险信号。这些受体识别的不是模式,而是干扰,因此能够区分有害和无害,而不一定区分非自我和自我,因为这些干扰可能来自外源和内源性。在大多数情况下,先天免疫受体引发转录程序,如细胞因子、趋化因子和抗菌肽的表达,以发挥宿主防御作用;然而,有时它们会导致细胞死亡以阻止病原体的繁殖,这是绝望情况下需要采取的绝望措施。
在这种情况下,炎性小体是激活 Caspase-1 或其他炎性 Caspase的细胞质超分子复合物,虽然一些炎性小体传感器是PRR,但另一些是扰动检测器。研究最多的炎性小体之一是NLRP3炎性小体,它正在成为细胞应激和细胞膜损伤的扰动检测器。
NLRP3(也称为cryopyrin)属于含核苷酸结合结构域(NBD)和亮氨酸重复序列(LRR)的蛋白质(NLR)家族。NLRP3 已被发现在髓系免疫细胞中表达,如中性粒细胞、单核细胞和树突状细胞;屏障细胞;淋巴细胞;它与影响不同年龄段的许多人类疾病有关
NLRP3的遗传畸变导致统称为低温比林相关周期综合征(CAPS)的疾病。从较轻到较重,CAPS 表现为家族性冷自炎症综合征、Muckle-Wells 综合征和新生儿发病的多系统炎症性疾病,影响皮肤、关节甚至中枢神经系统。NLRP3 炎性小体也被证明在许多常见疾病中起着重要作用,从2型糖尿病和肥胖等代谢紊乱到阿尔茨海默病和帕金森病等中枢神经系统疾病,再到各种癌症
NLRP3激活需要两个步骤,一个启动步骤和一个激活步骤。首先,在识别 PAMPs 或 DAMPs 后,PRRs 或参与免疫和炎症反应的细胞因子可以启动 NLRP3 的表达。在 NF-κB 或其他转录因子激活后,NLRP3 和其他炎性体成分的表达在转录上上调。NLRP3 的翻译后修饰,包括泛素化、磷酸化和sumoylation,也会使NLRP3激活,同时仍将NLRP3保持在自抑制状态。在第二步中,NLRP3被各种微生物和无菌刺激激活,这些刺激通常会收敛到 \(K+\) 流出或其他离子变化。这些刺激包括细菌毒素,如黑曲霉素,细胞外 ATP,以及颗粒物,如尿酸晶体、胆固醇晶体和淀粉样蛋白。重要的是,一种有助于有丝分裂的丝氨酸/苏氨酸激酶NEK7(NIMA 相关激酶7)已被发现通过直接结合在NLRP3激活中发挥关键作用。激活后,NLRP3组装并招募下游成分形成炎性小体复合体,激活的炎性 Caspase蛋白水解细胞因子,产生成熟形式并诱导高度炎症形式的细胞死亡,称为焦亡
NLRP3炎性小体通路
NLRP3 炎性小体的形成是一个信号级联,可以通过三个典型的组件来分离和定义:传感器、适配器和效应器。这些作用分别由NLRP3、ASC(凋亡相关斑点样蛋白,由 CARD 和 PYD 构成)和 Caspase-1 发挥
传感器 NLRP3 由三部分组成:氨基(N)末端的 pyrin 结构域(PYD)、羧基(C)末端的 LRR 和一个称为 NACHT 的含有 ATP 酶结构域的中心 NBD(图1a)。PYD 通常以同型方式相互作用以调节下游信号。LRR 结构域主要介导蛋白质相互作用,NLRP3 的 LRR 也与维持 NLRP3 稳定性有关。NACHT 结构域具有结合核苷酸和水解 ATP 的能力,一旦被触发,可能会经历 ATP 依赖性的自寡聚化,导致自身 PYD 相互作用,进一步招募适配器 ASC
Caspase-1 由N端 CARD、称为 p20 的大催化亚基和称为 p10 的 C 端小催化亚基组成(图1b)。 Caspase-1 CARD 与聚集的 ASC CARD 相互作用,并经历类似的有核细丝形成。这些细丝诱导 Caspase-1 的 p20 和 p10 催化亚基的接近诱导二聚化,并在 p20 和 p10 之间的接头处自我切割,使 Caspase-1 具有完全的蛋白水解活性。尽管这些蛋白质可以假设的化学计量范围没有生物物理限制,但根据定量蛋白质印迹,细胞中 ASC 和 Caspase-1 之间的相对丰度估计为1:3.5。一旦激活, Caspase-1就能够切割和激活导致焦亡的 gasdermin D(GSDMD),并将 IL-1 家族中的促细胞因子转化为成熟的促炎细胞因子,这对调节免疫反应至关重要
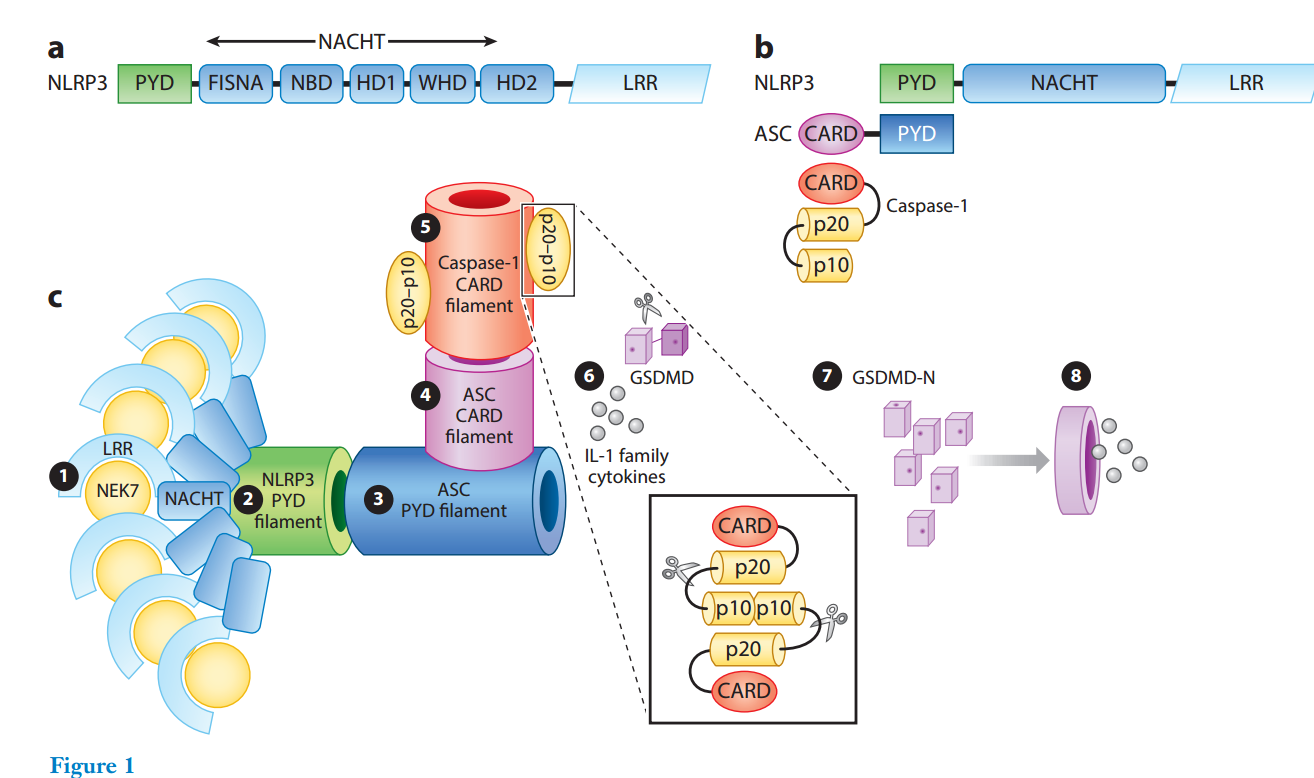
NLRP3的结构和抑制剂结合模式
作为典型的 NLR,NLRP3 的 NACHT 结构域由 FISNA(鱼类特异性NACHT相关结构域)、NBD、螺旋结构域1(HD1)、带翼螺旋结构域(WHD)和螺旋结构域2(HD2)组成;LRR结构域包含多个LRR重复单元
NLRP3-NEK7 复合物的低温电子显微镜(cryo-EM)结构首次揭示了 NLRP3 的 NACHT 和 LRR 结构域的结构,并得到了后续 NLRP3 低温EM研究的进一步支持。与 NOD2 和 NLRC4(53-56)等其他 NLR 类似,NLRP3 的 NACHT 和 LRR 结构域显示出保守的耳环形状
对于 NLRP3,NBD 由α螺旋包围的中心β片形成,HD1、HD2 和 WHD 主要由 α 螺旋构成,LRR 由12个重复序列构成
FISNA 结构域在非活性 NLRP3 中部分无序,以前被认为是 NBD 的一部分,在活性 NLRP3 中完全有序。NBD、HD1 和 WHD 在 NLRP3、NOD2 和 NLRC4 之间共享相似的架构。HD2 和 LRR 的构象不同,因为 HD2 与 LRR 具有不同的形状和取向,并且在形状卷曲程度、亮氨酸富集重复片段的数量上也有所不同
在非活性状态下,ADP 与 WHD、HD1 和 NBD 包围的 NACHT 结构域内 NLRP3 的核苷酸结合口袋结合。一种抑制剂MCC950(也称为CRID3)已被证明可以直接抑制NLRP3。这种抑制剂,以及使用它作为模板创建的另一种抑制剂,已被发现与 ADP 附近的NACHT结构域结合
在活性状态下,ATP 可能与 NLRP3 结合,但这种构象尚未被捕获。PYD 属于死亡结构域(DD)超家族,具有典型的六螺旋束结构(图2c)
NLRP3低聚反应
由于 PYD 缺失的 NLRP3 用于确定 NLRP3-NEK7 复合物的结构被设计为单体,为了了解天然形式的 NLRP3,该领域转向全长 NLRP3 蛋白。哺乳动物细胞中表达的小鼠 NLRP3s,在不添加核苷酸的情况下,当 ADP 和 MCC950 存在时,或在 dATP(可水解为 dADP)存在时都显示出大的寡聚结构(图2d)。用 ADP 和 MCC950 处理的 NLRP3 颗粒产生了 200Å 至 250Å 的六倍、七倍和八倍双环笼结构,每种结构分别含有12、14和16个单体,而用 dATP 处理的颗粒更均匀地含有12个单体并在 3D 重建中达到了最佳分辨率。随后对全长小鼠 NLRP3 的独立研究进一步支持了十二聚体的结构
总体而言,由于整体圆形轮廓和中心的中空性,双层环形十二面体以及 14- 和 16-mer 看起来像一个笼子或桶。十二聚体由遵循 D6 对称性的12个单体形成,其中所示的顶面和底面被6个 NACHT 结构域占据,这些结构域处于非活性构象,彼此之间的相互作用不够紧密。重要的是,12个 LRR 结构域环绕着十二聚体,形成其侧面,对其形成贡献最大。在两个环的相邻LRR域之间形成面对面和背对背的界面,其中LRR域分别使用其凹面和凸面相互结合。这些界面上的残留物对于诱变显示的笼形成至关重要。还使用冷冻 EM 研究了全长人 NLRP3 的寡聚化,在ADP和MCC950的存在下,解决了一个较小的十聚体笼(图2e),与小鼠NLRP3笼结构相似(49)。尽管确切的寡聚状态因物种和结合的核苷酸而异,但NLRP3寡聚体之间的结构一致性是双环组织,每个环拥有5-8个NLRP3分子
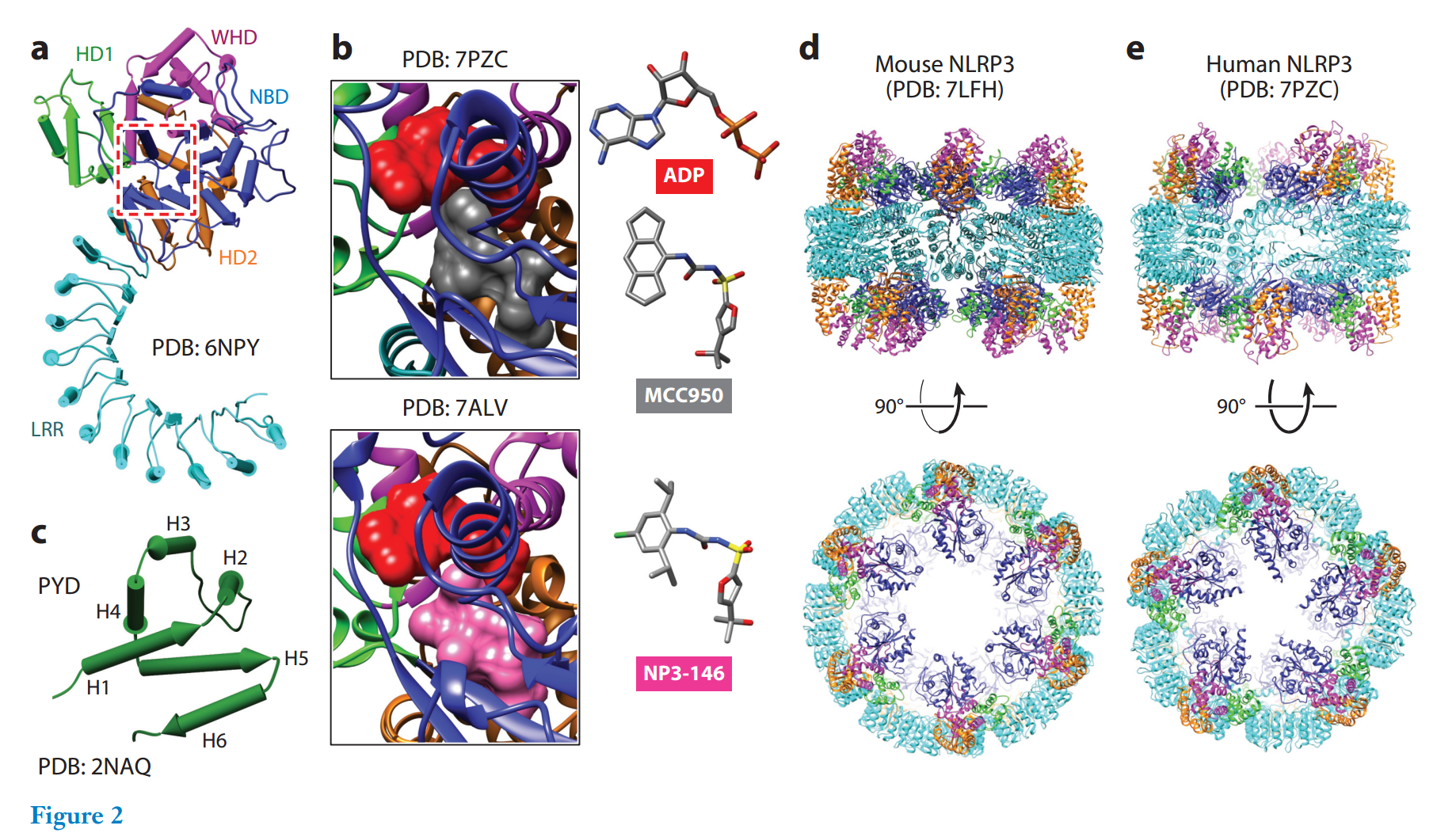
NEK7 -> NLRP3激活的结构机制
人 NEK7 是一种小的丝氨酸/苏氨酸激酶,不仅在有丝分裂中起着先决条件作用,而且是 NLRP3 激活所必需的。与其他 NEK 一样,NEK7 包含一个较小的 5β 链N瓣和一个较大的主要是 α 螺旋C瓣,由一个柔性铰链连接。在 NLRP3-NEK7 复合体的低温 EM 结构中,发现了 NEK7 C瓣的密度,而 NEK7 N瓣的密度不可见。当全长 NEK7 结构覆盖在 NLRP3-NEK7 图上,C瓣很好地拟合时,N瓣不会对复合物产生空间干扰,表明 NEK7 N瓣可能不参与 NLRP3 相互作用。NEK7 C瓣的密度被 NLRP3 LRR 域包围,其前半部分与 LRR 相互作用,后半部分与 NACHT 中的 NBD 和 HD2 相互作用
NLRP3 和 NEK7 C叶的等电点分别为6.2和9.0,表明两者之间的相互作用在很大程度上是基于静电互补的。重要的是,根据诱变研究,只有 LRR 和 HD2,而不是 NBD,在 NLRP3-NEK7 结合界面中起着至关重要的作用
然而,不应忽视 NBD 在 NLRP3 激活中的重要性,因为与 NACHT 中的其他亚结构域相比,NBD 包含更多的疾病相关突变;这些突变残基参与 ATP 结合或催化,或简单地埋在它们自己的结构域内,可能会破坏 NLRP3 的无活性构象,从而引发下游免疫活动
虽然 NLRP3 既可以与 NEK7 自结合又可以相互作用,但由于 NLRP3-LRR 结构域的凹侧不仅充当 NEK7 的结合位点,还充当笼结构中 NLRP3 自组装的结合位点。由于空间碰撞,NEK7 相互作用与笼形成是互斥的(图3b)。事实上,当存在 NEK7 时,纯化的 NLRP3 笼的数量减少,出现了更小的 NLRP 三种,这表明 NEK7 与 NLRP3-NLRP3 结合位点竞争,破坏了双环笼,这应该发生在 NLRP3 被运输到微管组织中心并与 NEK7 共定位时
NEK7参与NLRP3炎性体生物学具有额外的意义。NEK7 C叶的前半部分不仅参与与NLRP3的结合,还参与有丝分裂过程中与 NEK9 的相互作用(80)。由于 NEK7 上的结合位点在 NLRP3 和 NEK9 之间部分共享,因此当 NEK7 的量受到限制时,NLRP3 激活和有丝分裂可能会相互负调控
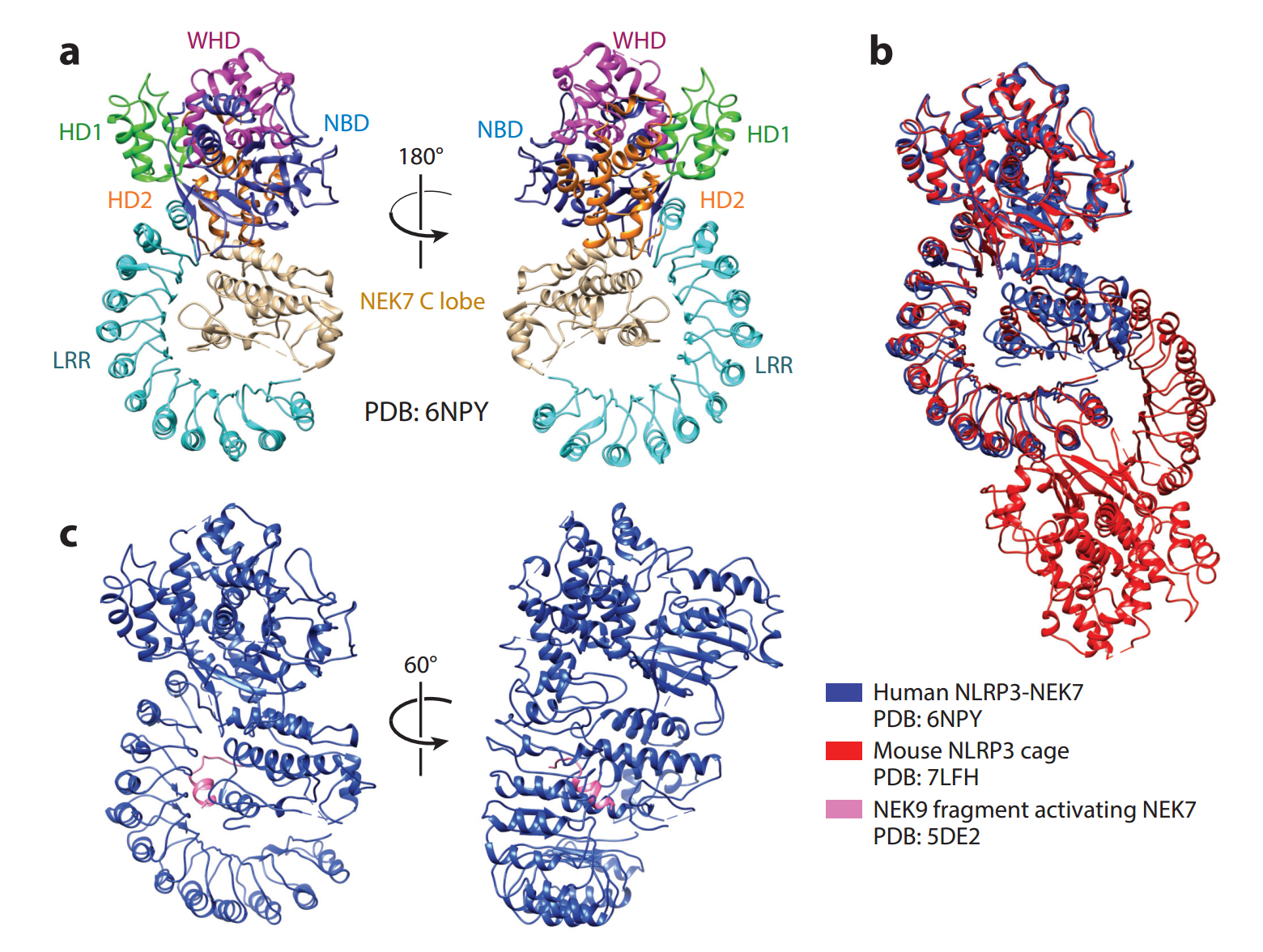
活动性NLRP3炎性体盘
尽管从非活性态 NLRP3 结构中获得了很多信息,但迄今为止,NLRP3的活性态构象和组装仅基于已知的活性NLRC4结构进行预测。新的活性NLRP3炎性体盘(图4a,b)最终揭示了其构象变化、核苷酸交换和组装模式
Xiao 等人用三种主要成分 NLRP3、NEK7 和 ASC 重构了活性 NLRP3 炎性体,其中 NEK7 与 NLRP3 的 LRR 结构域结合,ASC 通过与 NLRP3 形成 PYD-PYD 细丝来稳定炎性体组装。在负染电子显微镜下观察到细丝呈长线状尾部,细丝的冷冻电镜结构与之前发表的研究中的结构相似,这些研究将在下一节“NLRP3 炎性体中的 PYD-PYD 相互作用”中介绍。重要的是,这种活性构象被 ATP 类似物 5-O-(3-硫代)三磷酸腺苷(ATPγS)锁定,它模仿 ATP 并与 NLRP3 的 NACHT 结合(图4d,e)
低温EM重建产生了两个花形盘,分别包含 NLRP3-NEK7-ASC 复合物的10个亚基和11个亚基,以及一些主要包含5个亚基的部分盘。NLRP3和ASC之间形成的PYD细丝仅在全盘中观察到,而不是部分盘,这表明只有全盘能够有效地招募ASC。直径约为320˚a的10亚基盘已被用于进一步分析(图4a,b)
NLRP3-NACHT 域在磁盘中心相互作用,一侧主要与 NBD、WHD 和 HD2 相互作用,另一侧主要与 FISNA 和 HD1 相互作用。NEK7 绑定的 NLRP3 LRR 位于远离中心的位置(图4a,b),表明 NLRP3 LR 和 NEK7 都没有直接参与磁盘组件。事实上,NEK7 可能在打破非活性 NLRP3 笼中发挥作用,而不是促进 NLRP3 原聚体之间的相互作用
当 NLRP3 从非活性变为活性时,会发现剧烈的构象变化。WHD-HD2-LRR 区域在叠加有源和无源 NLRP3 的 FISNA-NBD-HD1 区域的同时,经历了约85.4°的刚体旋转(图4c)。特别是,FISNA 区域在磁盘组装中起着非常重要的作用。FISNA 不仅参与 ATPγS 结合(图4d,e),还参与圆盘中NLRP3分子之间的相互作用(图4a,b)。具体而言,作为非活性 NLRP3 中部分无序的区域,FISNA 在活性 NLRP3.中变得完全有序。FISNA 的有序环1和环2,以及 HD1 和 WHD 的 β-发夹环,桥接并稳定了磁盘中两个相邻的 NLRP3
基于前两节讨论的活性 NLRP3 盘和非活性 NLRP 三结构,包括寡聚笼和与 NEK7 复合的 NLRP3,Xiao 等人提出,NLRP3 炎性体途径可能包含以下步骤:NLRP3 表达的启动和上调、反高尔基体网络中 NLRP3 寡聚笼的形成、反高尔基网络分散和囊泡运输到微管组织中心、NEK7 结合打开 NLRP3 笼以及活性 NLRP3-盘组装(图4f)。最后两个步骤表明,完整的圆盘可能是由 NLRP3 笼的两个半环形成的,在笼解离后重新排列。后续步骤包括 NLRP3-PYD 在圆盘中心的成核和细丝形成,随后是 ASC 补充和 NLRP3 和 ASC 之间的混合 PYD-PYD 细丝的形成。

NLRP3炎性小体中PYD-PYD相互作用
衔接蛋白 ASC 具有N端 PYD 和C端 CARD,并将 NLRP3 连接到胱天蛋白酶-1。在 NLRP3 刺激下,全长内源性ASC分子通过PYD-PYD相互作用与NLRP3相互作用,并通过CARD-CARD相互作用与胱天蛋白酶-1相互作用,形成斑点状聚集体。ASC 斑点可能含有交联的 PYD 和 CARD 丝,因为仅 ASC-PYD 和仅 ASC-CARD 片段在细胞中形成长丝,这表明 ASC 蛋白的聚合特性。具体而言,PYD-PYD 和 CARD-CARD 相互作用是两种类型的同型相互作用,它们经历成核聚合,参与 NLRP3 炎性小体的信号传导和形成
PYDs 构成 DD 超家族中的一个结构域家族,其成员共享六螺旋束结构,并形成炎症信号传导的同型相互作用。NLRP3 和 ASC 的 PYD 结构高度相似,每个结构由六个反平行螺旋(α1-α6)组成,其中 α1、α2 和 α4-α6 紧密堆积在一起形成一个中心疏水核,而 α3 通常更短,更靠外(图2c)。尽管 NLRP3 和 ASC-PYD 与其他 PYD(如 NLRP1、NLRP7 和 NLRP10)在整体结构上具有相似性,但在细丝形成过程中发生构象变化的 α2-α3 环(见下文)最为不同。
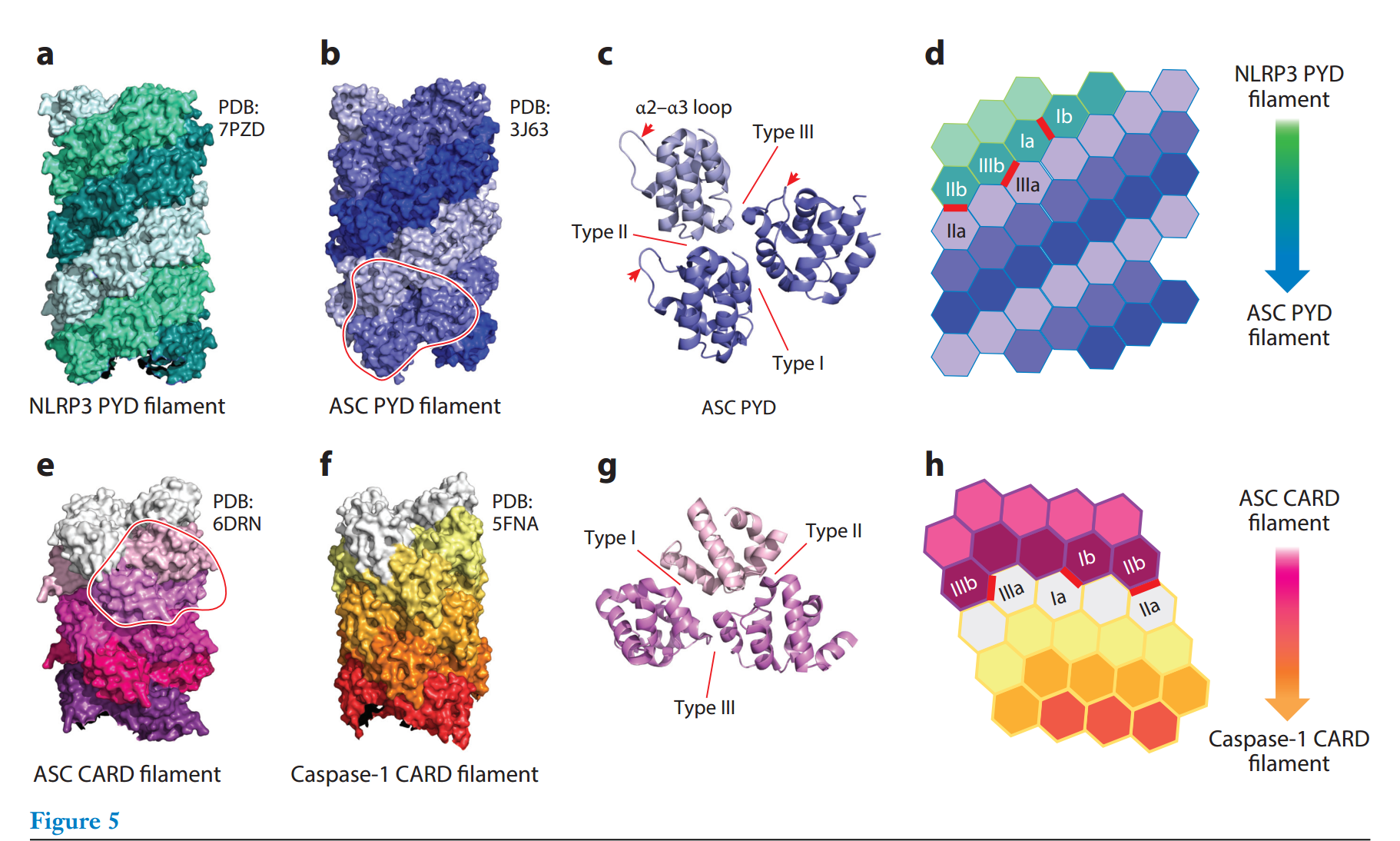
ASC-PYD 灯丝的低温EM结构揭示了第一个 PYD 灯丝结构,最近报道的 NLRP3 灯丝结构具有类似的结构结构(图5a,b)。ASC-PYD 长丝结构显示了一个三起点螺旋组件,遵循 \(C_3\) 点群对称性,子单元以螺旋状排列成螺旋线,每个子单元包含约 \(53°\) 的右旋旋转和约14˚a的轴向上升。灯丝的整体形状为圆柱形,外径约为 90Å,内径约为 20Å。细丝的形成是由强烈的电荷互补性促成的,这从细丝横截面上高度正和高度负的相对侧可以看出。尽管 NLRP3-PYD 与 ASC-PYD 的序列同一性有限,但其旋转的螺旋对称性和每个亚基的轴向上升几乎相同,电荷复合物也几乎相同
PYD 长丝是极性长丝,因为它们在长丝形成过程中需要构象变化而单向聚合。对于 ASC -PYD,观察到溶液中 ASC-PYD 的 NMR(核磁共振)结构和细丝中 ASC-PYE 的低温EM结构之间的构象差异,特别是在参与细丝中典型不对称相互作用的 α2-α3 环,I、II和III型(图5c)。I型相互作用由一个亚基的 α1 和 α4 残基以及相邻链内亚基上的 α2 和 α3 残基形成;II型相互作用由一个亚基的 α4-α5 角残基和相邻链间亚基的 β5-α6 角残基形成;III型相互作用是由一个亚基的 α2-α3 角残基和相邻链间亚基的 α1-α2 角残基形成的。
已经模拟出,低聚的 NLRP3-PYD 会形成 ASC-PYD 丝,实验上,活化的 NLRP3 会诱导 ASC 变成丝状(图5d)。细丝的结构和电荷分布的相似性解释了 ASC-PYD 亚基如何被招募到 NLRP3-PYD 细丝中并伸长以形成连接的 ASC-PYD 细丝。在 NLRP3 炎性体中,有核 ASC-PYD 丝很可能聚集 ASC-CARD,为通过 CARD-CARD 相互作用招募效应子胱天蛋白酶-1提供平台。
CARD-CARD 相互作用与半胱氨酸天冬氨酸蛋白酶激活
与 PYD 一样,CARD 也属于 DD 超家族,ASC-CARD 和胱天蛋白酶-1 CARD 都表现出六螺旋束结构,这从单个亚基的晶体和 NMR 结构以及相应细丝的低温EM结构中可以看出。胱天蛋白酶-1 CARD 细丝和 ASC-CARD 细丝。然而,与上述 PYD 丝不同,胱天蛋白酶-1和 ASC-CARD丝具有左旋单起始螺旋对称性,每个亚基旋转约\(-100°\),上升5Å。从 PYD 细丝结构中了解到,还发现了三种相互作用类型。然而,III型界面形成在螺旋股线内,而I型和II型界面形成于不同股线上的亚基之间
进一步表明,胱天蛋白酶-1 CARD 丝由上游 ASC-CARD 丝单向和分层成核和组装(图5h),通过电荷和形状互补介导异源寡聚 CARD-CARD 相互作用。ASC-CARD 对胱天蛋白酶-1 CARD的直接募集在 ASC-CARD 和胱天蛋白酶-1 CARD 的工程融合构建体中得到了进一步证明,该构建体显示了一个含有四个 ASC-CARD 分子和四个胱天蛋白酶-1 CARD 分子的八聚体 CARD 丝。如前所述,一旦通过 CARD-CARD 相互作用招募,胱天蛋白酶-1催化结构域二聚化被激活,然后蛋白水解介导 GSDMD 激活和细胞因子成熟
胱天蛋白酶-1的不同自加工形式在细胞死亡和细胞因子成熟方面表现出不同的活性(图1c)。全长胱天蛋白酶-1二聚体,也称为 p46,有效地加工 GSDMD,导致 GSDMD N端片段形成大的跨膜β-桶孔,以驱动焦亡。当催化结构域内 p20 和 p10 之间的接头被自动加工时,产生的 p33/p10 胱天蛋白酶1具有完全的催化功能,可以加工 GSDMD 以外的更多底物,包括许多促炎细胞因子,如 IL-1β 和 IL-18,正如早期研究所揭示的那样。成熟的细胞因子通过 GSDMD 孔离开细胞。随后在 CARD 结构域接头处高压裂解后,产生的 p20/p10 胱天蛋白酶-1从炎性小体复合物中释放出来,在细胞中变得不稳定,并失去蛋白酶活性
结论:不同NLR蛋白的不同机制
作为细胞膜损伤的扰动传感器,NLRP3炎性小体近年来因其在信号传导、炎症和细胞死亡方面的广泛生物学特性而受到广泛关注;它与先天性和后天性人类疾病的关系;及其作为治疗靶点的潜力。NLRP3 炎性小体的结构发现为超分子复合物中的蛋白质如何相互合作组装和激活胱天蛋白酶-1提供了关键的见解。结合光学显微镜和其他细胞生物学研究,这些结构见解暗示了一种复杂的 NLRP3 激活机制,除了决定组装的蛋白质相互作用外,还需要广泛的细胞内运输。NLRP3 属于 NLR 蛋白家族,其中许多蛋白组装炎症小体。
本文综述了 NLRP3 的研究,并与其他 NLR 炎性小体揭示的机制进行了对比。例如,NLRP1 炎性体感知病原体或内在应激引起的异常细胞内蛋白酶或泛素连接酶活性,并通过 NLRP1 N端区域的调节蛋白水解被激活,以释放活性C端区域用于细丝形成、ASC 募集和胱天蛋白酶-1激活。其他 NLR 炎症小体,即参与肠道和肝脏宿主防御的 NLRP6 炎症小体,被证明可以直接与 dsRNA(一种PAMP)相互作用,形成液-液相分离,这反过来又提高了 NLRP6 的局部浓度,以招募 ASC 和胱天蛋白酶-1。因此,虽然这些 NLR 炎性小体收敛到胱天蛋白酶-1激活的相同结果,但它们使用不同的机制实现了这一结果,说明了结构如何发挥其功能。未来的研究可能会揭示 NLR 家族更多意想不到的结构和生物学。


 浙公网安备 33010602011771号
浙公网安备 33010602011771号